Teflonverschluss |
  Klare, farblose und leicht bewegliche Flüssigkeit Vorkommen Steinkohle, Erdöl |
Molmasse 78,112 g/mol AGW k.A., krebserzeugender Stoff Dichte 0,8788 g/cm3 Schmelzpunkt +5,538 °C Siedepunkt +80,08 °C Wasserlöslichkeit Konz. bei 20 °C 1,8 g/l Brechungsindex (20°C) 1,5011 Explosionsgrz. 1,2 bis 7,8 Vol.-% (Luft) Flammpunkt −11 °C Zündpunkt +498 °C |
| Piktogramme GHS 02 GHS 07 GHS 08 Gefahr |
Gefahrenklassen
+ Kategorie Entzündbare Flüssigkeiten 2 Ätz-/Reizwirkung auf die Haut 2 Schwere Augenschäd./-reizung 2 Keimzellenmutagenität 1A Karzinogenität 1A Spez. Zielorgan-Toxizität w. 1 Aspirationsgefahr 1 |
HP-Sätze (siehe auch Hinweis) H 225, 304, 315, 319, 340, 350, 372, 412 P 210, 260, 280.1-4,6,7, 301+310, 305+351+338, 308+313, 403+233 Entsorgung G 1 |
| Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
|
| CAS 71-43-2 | Benzol Benzen |
Benzene [6]Annulene |
Bemerkung
für
Schulen: Benzol ist ein stark krebserzeugender Arbeitsstoff. Er darf
im Schullabor nicht aufbewahrt und auch nicht eingesetzt werden. Da
Benzol als Antiklopfmittel in Autobenzin enthalten ist, darf dieses an
Schulen im Chemieunterricht nicht eingesetzt werden.
Wirkung auf den menschlichen Körper Benzoldämpfe
wirken
beim Einatmen sehr toxisch. Die Symptome
äußern sich in
Schwindel,
Erbrechen und Bewusstlosigkeit. Die Flüssigkeit
kann auch über
die Haut aufgenommen werden und verursacht auf diesem
Weg schwere
Vergiftungen.
Bei einem Benzolgehalt von zwei Volumenprozent in der
Atemluft tritt der
Tod nach fünf bis zehn Minuten ein. Chronische
Vergiftungen bei
Aufnahme von kleineren Mengen
über einen längeren Zeitraum führen zu
einer Schädigung des Knochenmarks, der Leber und der Nieren. Benzol
kann Leukämie hervorrufen und gilt als stark krebserzeugender
Stoff.
Eigenschaften Benzol ist eine klare,
leicht bewegliche Flüssigkeit, die mit einem Brechungsindex von 1,5011 stark lichtbrechend ist. Benzol mischt sich mit Wasser kaum, beim Mischen schwimmt es aufgrund seiner
geringeren Dichte oben. Ethylalkohol, Diethylether, Benzin, Fette, Harze,
Phosphor und Iod lassen sich in Benzol gut lösen.
Wasserschicht, es ist stärker lichtbrechend als Wasser. An der Luft verbrennt
der Kohlenwasserstoff Benzol mit rußender Flamme unter Bildung von CO2 und H2O. Aufgrund der dabei hohen, entstehenden Verbrennungswärme
und seiner Eigenschaft, Frühzündungen im Ottomotor – dem „Klopfen“
– zu verhindern, wird er als Zusatzstoff im bleifreien Benzin verwendet.
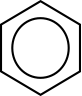
Benzol ist aufgrund seines Benzolrings im Molekül-Bau der einfachste Vertreter der Aromaten.
Die Addition von Halogenen gelingt mit UV-Licht: Wenn sechs Chlor-Atome am Benzolring addiert werden, erhält man Hexachlorcyclohexan, das verschiedene Diastereomere bildet: Bekannt geworden ist γ-Hexachlorcyclohexan unter dem Namen Lindan. Es ist ein in der Natur schwer abbaubares
Insektenvernichtungsmittel, das sich in der Nahrungskette anreichert.
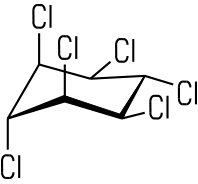 γ-Hexachlorcyclohexan (Lindan) Mesomerie im Benzolmolekül Bei der Darstellung des Benzol-Moleküls gäbe es theoretisch zwei Möglichkeiten. Der Mesomerie-Pfeil und die eckige Klammer verdeutlichen, dass die beiden dargestellten Grenzstrukturen nicht wirklich existieren: 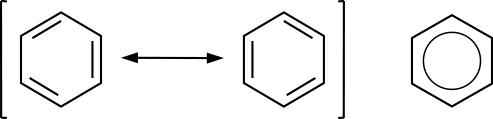 Da der Bindungsabstand
zwischen einer Einfachbindung und einer Doppelbindung verschieden ist,
müsste ein unregelmäßiges Sechseck entstehen. Mit Hilfe
der Röntgenstrukturanalyse lässt sich aber errechnen, dass die
Bindungslängen zwischen allen C-Atomen im Benzol gleich sind. Die
Elektronen sind daher ringförmig in den Elektronenwolken verteilt,
sie sind delokalisiert und richten eine symmetrische Struktur aus. Der
Ring bei der Darstellung des Benzol-Moleküls verdeutlicht dies.
Es liegen nach Paulings Hybridorbital-Modell π-Bindungen vor. Diese Erscheinung der
delokalisierten Elektronen nennt man Mesomerie oder Resonanz. Sie kommt bei zahlreichen anderen
anorganischen und organischen Verbindungen vor, so auch beim Lachgas.
Der Resonanzbegriff bei chemischen Bindungen geht auf Pauling zurück.
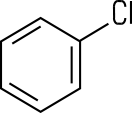
Herstellung von Halogenaromaten
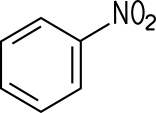
Die Wasserstoff-Atome am Benzolring lassen sich bei Gegenwart von Eisen(III)-chlorid mit Halogenen substituieren: Mit Chlor entsteht flüssiges Chlorbenzol, das als Lösungsmittel verwendet und zur Phenol-Synthese benötigt wird. Bei der Bromierung von Benzol mit Brom unter Einsatz des Katalysators Eisen(III)-bromid FeBr3 entstehen die aromatisch riechende Flüssigkeit Brombenzol und gasförmiger Bromwasserstoff: Benzol + Brom C6H6 + Br2 Diese Reaktion ist ein Lehrbuchbeispiel für eine typische Elektrophile aromatische Substitution SEAr. Das Fe3+-Ion im Katalysator FeBr3 ist eine starke Lewis-Säure, die Elektronenpaare aufnehmen kann. Dadurch wird das Br2-Molekül polarisiert. Das nukleophile π-Elektronensystem des Benzolrings verstärkt diese Polarisation beim Annähern zusätzlich. Ein Brom-Atom im Br2-Molekül wird dadurch positiv polarisiert und wirkt elektrophil: 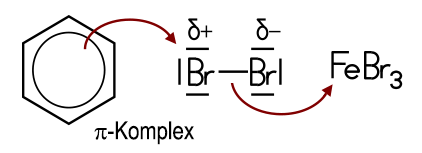 Das System aus dem polarisierten Brom-Molekül und dem π-Elektronensystem wird als π-Komplex bezeichnet. Diese Wechselwirkung führt zur Spaltung des Br2-Moleküls: Ein Brom-Atom wird über eine σ-Bindung an ein C-Atom des Benzolrings gebunden. Es entsteht ein positiv geladenes Zwischenprodukt, das auch als Arenium-Ion oder als σ-Komplex bezeichnet wird. Dieses ist nicht aromatisch und daher energetisch ungünstig. Das andere Brom-Atom bildet zusammen mit dem Katalysator ein FeBr4−-Ion: 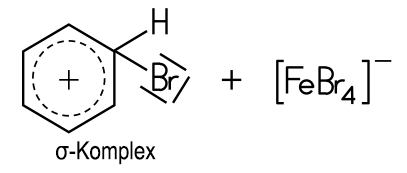 Durch die Abspaltung eines Protons wird die Aromatizität des Benzolrings wiederhergestellt. Das entstehende Brombenzol ist deutlich stabiler als das Zwischenprodukt. Das abgespaltene Proton verbindet sich mit einem Bromid-Ion aus dem FeBr4−-Ion zu HBr. Der Katalysator liegt anschließend wieder in seiner ursprünglichen Form vor: 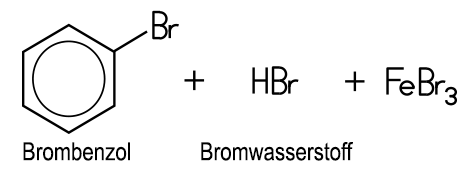 Folie: Reaktionsmechanismus Nitrobenzole und Azobenzole Mit Nitriersäure, einem Gemisch aus rauchender Salpetersäure und konzentrierter Schwefelsäure, erhält man Nitrobenzol, ein wichtiges Zwischenprodukt zur Anilin-Herstellung. Beim erneuten Nitrieren lassen sich auch Dinitrobenzol und Trinitrobenzol darstellen. Sämtliche Nitrobenzole sind stark toxisch, Trinitrobenzol ist ein brisanter Sprengstoff.
Nitrobenzol
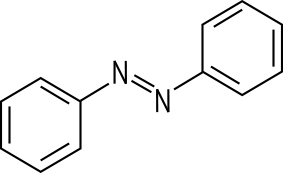
kann auch zur Herstellung von Azobenzol verwendet werden. Dieses Zwischenprodukt
zur Synthese von Azofarbstoffen erhält man beispielsweise durch eine
Reduktion von Nitrobenzol mit Lithiumaluminiumhydrid. Dabei entsteht die typische
Azogruppe -N=N-. Azobenzol bildet orangerote Blättchen, die sich in Wasser kaum, in
Alkohol jedoch gut lösen.
Dinitrobenzol und Azobenzol aus einer alten Chemikaliensammlung. |
| Herstellung Bei der fraktionierten
Destillation von Steinkohle erhielt der Alchemist Glauber im 17. Jahrhundert einen „scharpen Spiritus“ und ein „hitziges und bluthrothes Oleum“, das „alle feuchten Ulcera (heute: Geschwüre oder Entzündungen) gewaltig trocknet und
heilet“. Vermutlich erhielt Glauber dabei die Aromaten Benzol (ein „liebliches“ Öl) und Phenol.
Heute ist es schwer vorstellbar, dass diese stark giftigen Substanzen einst
als Heilmittel empfohlen wurden. Allerdings wirken sie stark keimtötend
und so lässt sich die Wirkung vielleicht einigermaßen nachvollziehen.
Im Jahr 1825 entdeckte Michael Faraday den Stoff in geleerten Gasflaschen einer Fabrik und konnte ihn dann auch isolieren. E. A. Mitscherlich (1794–1863) gewann den gleichen Stoff aus Benzoesäure und bezeichnete ihn zunächst als „Benzin“. 1834 vergab Justus von Liebig dem als „Benzin“ bezeichneten Stoff seinen Namen Benzol. Die erste Herstellung aus Teer erfolgte 1842 durch Leigh. August Kekulé von Stradonitz (1829–1896) stellte 1865 erstmals eine ringförmige Strukturformel für das Benzol-Molekül auf. Den Effekt der Mesomerie oder der Resonanz im Benzolmolekül erkannte aber erst Linus Pauling in den 1930er Jahren. Benzol entsteht heute bei der industriellen Destillation von Steinkohle und von Erdöl. Bei der Weiterverarbeitung des Erdöls fällt Benzol beim Cracken von Benzin und beim Platin-Reforming an. Beim Reformieren wird n-Hexan zuerst zu dem ringförmigen Cyclohexan und dann zu Benzol dehydriert: 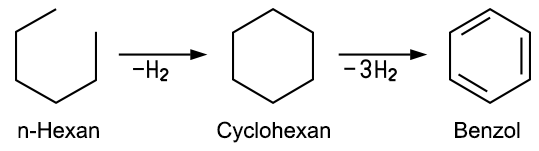 Herstellung von Benzol aus Benzoesäure und Natriumhydroxid im Labor
Im Labor kann Benzol aus Benzoesäure und Natriumhydroxid hergestellt werden. Dazu wird ein Gemisch der beiden Ausgangsstoffe kräftig erhitzt. Die Dämpfe werden abgeleitet und in einer Kühlfalle kondensiert. Nach einiger Zeit sammelt sich dort eine gelbliche Flüssigkeit. Diese riecht aromatisch und verbrennt mit stark rußender Flamme. Ein Gemisch aus Natriumhydroxid und Benzoesäure wird erhitzt. In der Vorlage sammelt sich eine gelbliche Flüssigkeit, die aromatisch riecht und unter starker Rußbildung verbrennt. Demonstration an Schulen nicht vorführen! >Film Bei der Reaktion von
Benzoesäure mit Natriumhydroxid läuft zunächst eine
Säure-Base-Reaktion ab. Die Benzoesäure gibt ein Proton ab,
das vom Hydroxid-Ion aufgenommen wird. Dabei entstehen Natriumbenzoat
und Wasser:
Benzoesäure + Natriumhydroxid C6H5COOH + NaOH Wird das gebildete Natriumbenzoat anschließend stark erhitzt, folgt eine basische Decarboxylierung. Unter Entfernung der Carboxylatgruppe entsteht Benzol: Natriumbenzoat + Natriumhydroxid C6H5COONa + NaOH Der dabei frei werdende Kohlenstoffdioxid-Anteil wird unter den stark basischen Bedingungen als Carbonat gebunden, weshalb Natriumcarbonat entsteht. Die Gesamtreaktion lautet: Benzoesäure + Natriumhydroxid C6H5COOH + 2 NaOH |
| Verwendung Benzol dient in Motorkraftstoffen
als Beimischung zur Erhöhung der Klopffestigkeit. Der Aromat ist Ausgangsstoff für viele organische und aromatische
Verbindungen wie Nitrobenzol, Anilin, Phenol, Styrol, Insektizide wie Lindan oder DDT,
Azo-Farbstoffe, Kunststoffe und Kunstharze. Benzol wird auch zur Waschmittelherstellung
benötigt. Es ist ein ausgezeichnetes, leider aber stark toxisches
Lösungsmittel
für Lacke, Harze, Wachse und Öle. Im Ausland
gefertigte Billig-Schuhe können Benzol-Reste enthalten, wenn
benzolhaltige Klebstoffe eingesetzt wurden.
|