Teflonverschluss |
 Farblose, glänzende Blättchen oder Nadeln Vorkommen Holzteer, Galläpfel |
Molmasse 126,110 g/mol AGW keine Angaben Dichte 1,453 g/cm3 Schmelzpunkt +125,5 °C Siedepunkt +307 °C Wasserlöslichkeit Konz. bei 20 °C 400 g/l Explosionsgrz. min. 1,4 Vol.-% (Luft) |
| Piktogramme GHS 07 GHS 08 Achtung |
Gefahrenklassen
+ Kategorie Akute Toxizität oral/dermal/inhalativ 4 Reizwirkung auf die Haut 2 Augenreizung 2 Keimzellenmutagenität 2 Gewässergefährdend chron. 3 |
HP-Sätze (siehe auch Hinweis) H 302, 312, 315, 319, 332, 341, 412 P 261, 264.1, 273, 280.1+3+7, 301+312, 302+352, 304+340, 308+313 Entsorgung G 3 |
| Etikett drucken | Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
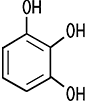
| CAS 87-66-1 | Pyrogallol 1,2,3-Trihydroxybenzol, Benzen-1,2,3-triol Pyrogallussäure |
Pyrogallol 1,2,3-Trihydroxybenzene, Benzene-1,2,3-triol |
Bemerkung
für Schulen: Es wird empfohlen, auf Schülerversuche mit Pyrogallol
zu verzichten. Pyrogallol sollte in dunklen Flaschen mit einer Teflondichtung aufbewahrt werden.
Wirkung auf den menschlichen Körper Pyrogallol reizt die
Schleimhäute und die Haut, bei Augenkontakt besteht die Gefahr einer
Schädigung. Dies gilt für allem beim Kontakt mit Dämpfen.
Die akute Vergiftung äußert sich in Erbrechen und Durchfällen,
der Tod tritt durch eine Atemlähmung ein. Schädigungen an der
Leber und Niere, sowie Blutschädigungen sind möglich. Die Vergiftungssymptome
ähneln dem Verlauf einer Resorcinvergiftung,
allerdings ist das Triphenol noch aggressiver als die Diphenole.
Eigenschaften Die weißen Nadeln oder Blättchen lösen sich gut in Wasser, in Ethylalkohol und in Diethylether. Sie färben sich an der Luft und unter Lichteinwirkung allmählich grau. Pyrogallol ist noch ein stärkeres Reduktionsmittel als Brenzcatechin oder Hydrochinon, es oxidiert an der Luft sofort, alkalische Lösungen absorbieren sehr begierig Sauerstoff und verfärben sich dunkel. Die wässrige Lösung reagiert nach einiger Zeit sauer, da als Oxidationsprodukte unter anderem Essigsäure und Kohlenstoffdioxid entstehen. Der früher gebrauchte Name "Pyrogallussäure" leitet sich von dieser Eigenschaft ab. Aufgrund seiner Eigenschaft, andere Stoffe gut reduzieren zu können, eignet sich Pyrogallol als Entwickler für die analoge Fotografie. Gold-, Silber-, Quecksilber- und Platinsalze können mit Pyrogallol leicht zu den Elementen reduziert werden. Auf diese Art und Weise lassen sich kolloidale Metalllösungen herstellen. Mit Eisen(III)-chlorid in wässriger Lösung entsteht eine Blaufärbung. |
| Herstellung Ein unreines Produkt
erhält man beim Rösten von Galläpfeln. Carl
Wilhelm Scheele (1742-1786) erhielt im Jahre 1786 das Pyrogallol bei
der trockenen Destillation (Pyrolyse) von Gallussäure (3,4,5-Trihydroxybenzoesäure). Die Gallussäure
oder Derivate davon finden sich vielfältig in der Natur, beispielsweise
in der Eichenrinde, in Galläpfeln oder bei den Sumachgewächsen. Der Stoff ist nach dem griechischen Wort pyr (Feuer) und der Ergänzung
"Gallol" benannt (abgeleitet von der Gallussäure und unter Bezug auf
die Hydroxygruppen). Das Herstellungsverfahren aus Gallussäure ist noch heute für
die chemische Industrie von Bedeutung: 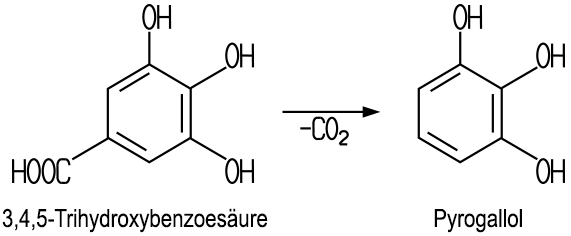 |
| Verwendung Pyrogallol wird in fotografischen
Entwicklern als Reduktionsmittel eingesetzt. In der Gasanalyse dient es
zur Absorption von Sauerstoff. Es
eignet sich als Stabilisator für reaktive Stoffe, die gerne mit Sauerstoff
reagieren. Wird es Diethylether zugesetzt, verhindert
es die Ausbildung von explosiven Peroxiden. Früher diente es als Haarfärbemittel,
heute ist dies aber nicht mehr erlaubt. Die medizinische Anwendung bei
Schuppenflechte gehört aufgrund der gefährlichen Nebenwirkungen
ebenfalls der Vergangenheit an. Die chemische Industrie benötigt Pyrogallol
in der Galvanotechnik und als Zwischenprodukt zur Herstellung von Farbstoffen
und Pestiziden. |