|
Die Rolle des Sauerstoffs bei Oxidationen
Inhalt
Didaktische Bemerkungen Demonstration 1 Eisenwolle verbrennt an einer Waage Demonstration 2 Eine Kerze verbrennt im abgeschlossenen Raum Demonstration 3 Stoffe reagieren reinem Sauerstoff Demonstration 4 Reaktionen in einer Kaliumnitratschmelze Demonstration 5 Der Rostvorgang als Beispiel für eine langsame Oxidation Ergänzende Informationen
Bei den Demonstrationen
zum Gesetz der Massenerhaltung zeigte sich, dass Masse nicht verloren
geht. Eine Kerze auf einer Waage wird zwar leichter, aber ein Teil der
Masse findet sich nach dem Abbrennen der Kerze in den Verbrennungsgasen.
An diesen Versuch knüpft der Einstieg in das Thema Oxidation
an. Diesmal hängt ein Büschel Eisenwolle an einer Waage und die
Schüler sollen vermuten, was passiert, wenn die Eisenwolle verbrennt.
Der Versuch provoziert zunächst jedoch einen Widerspruch.
Dieser Versuch muss auf einer feuersicheren Unterlage
durchgeführt werden, da brennende Eisenteile herunterfallen
können. Eisenwolle darf nie zusammen mit Batterien aufbewahrt
werden, da diese die Eisenwolle zünden können.
Zwei gleich große Stücke Eisenwolle werden an einer Balkenwaage befestigt. Nun zeigt man, wie ein kleineres Stück Eisenwolle (ohne Waage) verbrennt, in dem man es mit einer 4,5-Volt-Batterie zündet. Die Schüler sollen nun vermuten, was passieren wird, wenn eines der großen Stücke Eisenwolle an der Balkenwaage gezündet wird. Dabei werden sicherlich verschiedene Argumente vorgebracht:
Das letzte Argument werden
die Schüler zu diesem Zeitpunkt kaum einbringen, es sei denn ein Schüler
hat sich damit schon eingehend beschäftigt. Das Ergebnis der Demonstration
darf jedoch keinesfalls verraten werden. Man kann eine Abstimmung für
die drei Positionen durchführen lassen.
Beobachtungen:
Zur Verblüffung sicherlich mancher Schüler
wird die Eisenwolle beim Verbrennen schwerer. Und dies passiert, obwohl
viele glühende Stücke von der Eisenwolle abfallen und damit nicht
mitgewogen werden. Wie kann man sich das erklären? Bei der Untersuchung
des Reaktionsprodukts sieht man farbliche Veränderungen. Man kann
sie auch nicht mehr anzünden (sofern sie vollständig verglüht
ist).
Theorie: Auch
wenn man als Lehrperson schon weiß, warum die Eisenwolle schwerer
wird (Eisen reagiert mit Sauerstoff zu Eisenoxid), soll eine mögliche
Erklärung den Schülern zunächst vorenthalten werden. Stattdessen
folgt ein weiterer Versuch zur Klärung des Problems.
Bei der Demonstration
zur Erhaltung der Masse brannte eine Kerze auf einer Waage. Dabei handelte
es sich um ein offenes System, die Verbrennungsgase konnten entweichen.
Nun soll gezeigt werden, was passiert, wenn eine Kerze in einem geschlossenen
System verbrennt.
Die Kerze wird an einem Holzspan mit Tesafilm befestigt (siehe Bild), der Span in einen Stopfen gesteckt und dieser am Boden einer großen Petrischale mit Wachs befestigt. Dann füllt man die Petrischale 1 cm hoch mit Wasser und zündet die Kerze an. Damit sich der Standzylinder nicht am Boden ansaugt, kann man zwei Metallplättchen neben den Stopfen legen. Man zeigt den Zuschauern einen umgedrehten, schmalen Standzylinder und stellt die Frage, was passieren wird, wenn man den Standzylinder auf die Kerze stülpt. Wieder werden Vermutungen geäußert:
Beobachtungen:
Wie manche sicher richtig vermutet haben,
geht die Kerzenflamme nach einer Weile aus, während das Wasser in den Standzylinder hochsteigt.
Theorie:
Durch eine Anknüpfung an die Diskussion,
lassen sich jetzt Argumente für die exakte Beschreibung des Verbrennungsvorgangs
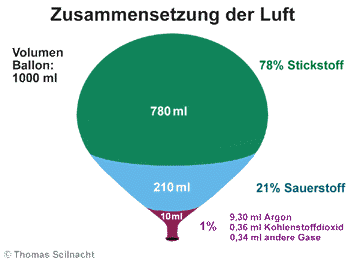
bei der Kerze finden: Bei der Verbrennung wird Luft benötigt. Von
der Luft ist es allerdings nur ein Anteil (ca. 20%), diesen Anteil nennen
wir Sauerstoff, das Restgas (ca.
80%) wird als Stickstoff bezeichnet.
Ist der gesamte Sauerstoff im Standzylinder verbraucht, geht die Kerzenflamme
aus. Danach befinden sich Stickstoff und Kohlenstoffdioxid im Standzylinder.
Beide Gase unterhalten die Verbrennung nicht. Zur Vertiefung wird eine
Grafik zur Luftzusammensetzung gezeigt.
In Anknüpfung an
den Versuch mit der Eisenwolle kann nun eine Erklärung
gesucht werden: Bei der Verbrennung der Eisenwolle wird ebenfalls Sauerstoff
benötigt. Dieser reagiert mit dem Eisen zu Eisenoxid. Die Waage zeigt
eine höhere Masse, da Sauerstoffatome chemisch mit dem Eisen gebunden
werden. Reaktionen mit Sauerstoff nennen wir Oxidationen. Dabei entstehen
als Reaktionsprodukte Oxide:
Reaktionsschema für
das Verbrennen der Eisenwolle:
Eisen + Sauerstoff Reaktionsschema für das Verbrennen des Rußes in der Kerzenflamme: Kohlenstoff + Sauerstoff
Die Versuchsreihe muss auf einer feuersicheren Unterlage durchgeführt werden. Eine Schutzbrille ist notwendig, bei der Reaktion mit Cer auch Schutzhandschuhe aus Leder und eine Schutzscheibe. Man sollte nicht direkt in die Flamme sehen. Bei der Reaktion des Sauerstoffs mit Schwefel entsteht toxisches Schwefeldioxid, daher sollte dieser Versuch im Abzug durchgeführt werden. Der restliche, möglicherweise noch brennende Schwefel wird über der rauschenden
Brennerflamme im Abzug verbrannt.
Mehrere Standzylinder werden mit reinem Sauerstoff gefüllt und bereit gestellt. Zum Schutz des Bodens gibt man in jeden Zylinder ein wenig Sand. Obwohl der Sauerstoff aufgrund der höheren Dichte als Luft in den Zylindern bleiben sollte, werden diese mit runden Glasscheiben abgedeckt, damit der Sauerstoff nicht durch Luftzirkulationen entweicht. a) Eine brennende Kerze wird auf einem Verbrennungslöffel in einen mit Sauerstoff gefüllten Zylinder getaucht. b) Ein Büschel Eisenwolle wird mit einer Tiegelzange gehalten, an einer Stelle zum Glühen gebracht und in den mit Sauerstoff gefüllten Standzylinder eingetaucht. c) Man füllt im Abzug einen Verbrennungslöffel zur Hälfte mit Schwefel und entzündet diesen mit einer Brennerflamme. Dann hält man den brennenden Schwefel in den mit Sauerstoff gefüllten Standzylinder.
d) Ein Joghurtglas wird
mit reinem Sauerstoff gefüllt und zugeschraubt. Dann wickelt man um
einen Zündstein aus Cer-Eisen satt einen Draht und erhitzt den Zündstein
bis zum Glühen in der nicht leuchtenden Brennerflamme. Der Draht mit
dem glühenden Zündstein wird in das Joghurtglas mit reinem Sauerstoff
getaucht.
Film Beobachtungen:
a) Die Kerzenflamme wird
heller und heißer, so dass Wachs an den Boden tropft. Ein glimmender
Span glüht ebenfalls hell auf und fängt sogar Feuer. Die Spanprobe
üben die Schüler bei der Schülerübung
zur Sauerstoffherstellung mit Kaliumpermanganat zu einem anderen Zeitpunkt.
b) Die Eisenwolle verglüht unter lebhafter Funkenreaktion. c) Der Schwefel verbrennt mit einer hell leuchtenden, blauen Flamme. d) Das Cereisen verbrennt explosionsartig mit sehr heller Flamme, wobei das Joghurtglas durch den Hitzeschock zerspringt.
Theorie:
Für die Reaktionen b) bis d) lassen sich
folgende Reaktionsgleichungen aufstellen:
Eisen + Sauerstoff 3 Fe + 2 O2 Schwefel + Sauerstoff S + O2 Cer + Sauerstoff Ce + O2
Für die Schüler
genügt an dieser Stelle eine Besprechung des Reaktionsschemas in Worten.
Bei der Reaktion von Cer mit Sauerstoff entstehen Temperaturen von bis
zu 4000 °C. Dadurch wird das Joghurtglas zerstört. Diese Reaktion
dient in Zündsteinen von Feuerzeugen oder Gasanzündern zum Anzünden
der Gase:
Entsorgung: Restlicher Schwefel wird im Abzug vorsichtig verbrannt.
Dabei entsteht stark toxisches Schwefeldioxid! Die Reste der Eisenwolle
werden erst im Abfall entsorgt, wenn sicher keine Glut mehr enthalten
ist. Cer in fein verteilter Form und auch das Produkt aus dem Versuch
mit Cereisen kann pyrophor sein. Da die Reaktion normalerweise fast
vollständig abläuft, reicht es aus, die Reste, die Unterlage
und auch die Glasreste mit viel Wasser gut abzuspülen und dann das
Glas im Behälter für Glasbruch zu entsorgen. Es wird generell
empfohlen, Abfälle für Feststoffe und Glas jeweils gesondert
in einem Metalleimer mit Metalldeckel zu sammeln.
Die nachfolgenden Versuche eignen sich weniger für die Schule, da
toxischer oder problematischer Abfall entsteht. Daher bieten sich die
Filme an. Die höchste chemisch
erreichbare Temperatur erhält man bei der Verbrennung von Zirconiumpulver
in reinem Sauerstoff (4660 °C):
Zr + O2
Variationen: Es
bieten sich Filme an, in denen weitere Beispiele für Oxidationen gezeigt
werden.
Verbrennungen sind den
Schülern aus verschiedenen Bereichen wohl bekannt. Am faszinierenden
sind wahrscheinlich die Verbrennungen, wie sie bei Explosivstoffen oder
Raketentreibstoffen auftreten. Die Reaktion zwischen Wasserstoff und Sauerstoff
fand im amerikanischen Space Shuttle eine technische Anwendung. Das im
Jahr 2011 ausgemusterte Space Shuttle führte einen Wasserstoff- und
Sauerstofftank mit sich. Die beiden Gase wurden im Triebwerk gezündet
und erzeugten die notwendige Energie zur Fortbewegung.
Beim Start des Space
Shuttles zündeten zunächst die seitlich sitzenden Feststoffraketen.
Feste Raketentreibstoffe führen Stoffe mit sich, die chemisch gebundene
Sauerstoff-Atome enthalten und als Oxidationsmittel wirken. Diese Erfahrung
ist aus der Schülerübung zur Herstellung
von Sauerstoff aus Kaliumpermanganat bekannt. Ferner benötigt
man einen Brennstoff, wie Kohle oder Schwefel, der beim Verbrennen mit
dem Sauerstoff die notwendige Energie liefert. Zunächst wird eine
(eventuell ausgebrannte) Feuerwerksrakete gezeigt und der Aufbau demonstriert.
Versuche zum Aufschneiden von Feuerwerkskörpern werden nicht empfohlen.
Beim Verbrennen von Schwarzpulver entstehen große Gasmengen, die einen Behälter sprengen. Dadurch wird der Knall beim Böller erzeugt. Befindet sich im Behälter einer Rakete ein kleines Loch, drängen die Gasmengen aus diesem Loch und ein Vorwärtstrieb wird erzeugt, so dass die Rakete fliegt. Die chemische Reaktionsgleichung für die Verbrennung von Schwarzpulver ist so kompliziert, dass sie nicht angegeben werden soll. Es entstehen Verbrennungsgase wie Kohlenstoffmonoxid, Kohlenstoffdioxid und Stickstoff. Beim Abbrennen von 10 g Schwarzpulver entstehen etwa 2,8 Liter dieser Gase (siehe auch Informationen bei den Demonstrationen zu den Explosivstoffen). Versuch: Dabei sind Schutzbrille und Schutzhandschuhe zu tragen, die Schutzbrillenpflicht gilt auch für Zuschauer, es sei denn, es wird eine Schutzscheibe eingesetzt. Es soll gezeigt werden, dass die Komponenten des Schwarzpulvers heftig miteinander reagieren können. Man gibt dazu in ein schwer schmelzbares Reagenzglas (18x180mm) 2cm hoch Kaliumnitrat und erhitzt mit der rauschen Brennerflamme bis eine klare Schmelze entsteht. Dann nimmt man den Brenner weg. In einer Versuchsreihe werden in die Schmelze nacheinander ein kleines Papierkügelchen, ein kleines Holzstückchen (ein halbes Streichholz ohne Zündkopf), 3 Körnchen Aktivkohle und eine Spatelspitze Schwefel geworfen. Man wartet nach jeder Reaktion und erhitzt erneut, bis die Schmelze wieder klar ist. In allen Fällen verbrennen die Stoffe lebhaft unter Feuererscheinungen. Die Demonstration zeigt die oxidative Wirkung des Kaliumnitrats.
Entsorgung: Geringe Reagenzglasreste der Kaliumnitratschmelze
können nach der vollständigen Abkühlung mit viel Wasser
verdünnt in den Abfluss gegeben werden. Werden Nitratlösungen
in einem Behälter zur Entsorgung gesammelt, ist darauf zu achten,
dass der pH-Wert alkalisch ist (pH=8), da in saurer Lösung Cyanwasserstoff entstehen kann.
Hinweis: Aufgrund des geltenden Rechts darf Schwarzpulver nicht im
Unterricht hergestellt werden. Stattdessen kann man Filme dazu vorführen.
Langsame Oxidationen
sind in der Natur ebenfalls weit verbreitet. Beim Atmungs- und Verdauungsvorgang
wird Traubenzucker über die Blutbahnen
zur Muskulatur und zum Gehirn transportiert. Dort oxidiert der Traubenzucker
mit Hilfe des Blutsauerstoffs, der aus der Atmung stammt, zu Kohlenstoffdioxid.
Dabei wird Energie frei. Traubenzucker enthält chemisch gebundene
Kohlenstoff-Atome, die zu Kohlenstoffdioxid oxidieren, das über den
Blutkreislauf und die Lunge wieder abgegeben wird.
Durchführung: Eine andere Form der langsamen Oxidation ist der Rostvorgang. Zwei Reagenzgläser werden mit Eisenwolle gefüllt. In einem Reagenzglas wird die Eisenwolle zusätzlich mit Wasser befeuchtet. Die beiden Reagenzgläser werden mit einem durchbohrten Stopfen verschlossen und mit langen Röhren versehen. Diese tauchen in mit blauer Tinte gefärbtes Wasser. Die ganze Apparatur wird mehrere Wochen stehen gelassen und beobachtet. 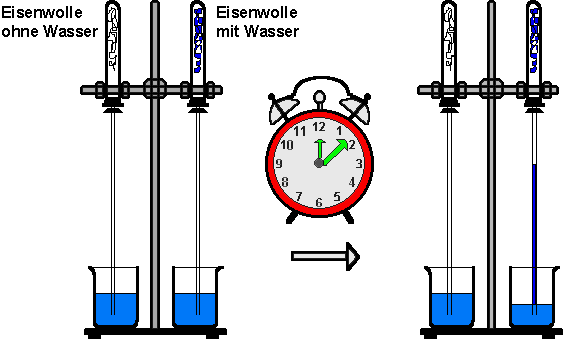
Beobachtung:
Nach zwei bis drei Wochen zeigt die
mit Wasser befeuchtete Eisenwolle deutliche Rostansätze. Das angefärbte
Wasser in dieser Röhre ist hochgestiegen, während sich im anderen
Reagenzglas keine Veränderungen zeigen.
Theorie:
Beim
Rostvorgang wird in einer komplizierten chemischen Reaktion Sauerstoff
verbraucht. Auch das Rosten ist eine Oxidation,
wobei Wärme frei wird. Das Reaktionsschema gibt den komplizierten
Rostvorgang stark vereinfacht wieder:
Eisen
+ Wasser + Sauerstoff
Das Eisenhydroxid reagiert dann mit dem Luftsauerstoff zu Eisen(III)-oxid (Fe2O3) weiter. Daneben entstehen auch andere Eisenoxide, zum Beispiel Eisen(II,III)-oxid (Fe3O4) oder Eisen(II)-oxid (FeO). Ausblick: Zur Vertiefung des Themas eignen sich Demonstrationen und Versuche zur Brandbekämpfung. Das Thema der Reduktionen schließt sich ebenfalls an. Variationen: Stellt man einen Eisennagel in ein offenes Gefäß mit kaltem, sauerstoffhaltigem Wasser, dann rostet der Nagel schneller, wie wenn er in ein geschlossenes Gefäß mit abgekochtem Wasser gelegt wird. |