Inhalt
Demonstration 1 Verbrennen einer Kerze im offenen System Demonstration 2 Dichtebestimmung mit Gaswägekugel und Kolbenprober Demonstration 3 Streichhölzer verbrennen in offenem und geschlossenem System
Das Gesetz
zur Erhaltung der Masse ist ein chemisches Gesetz, das schon von Antoine
Lavoisier und Michail W. Lomonossow im 18. Jahrhundert aufgestellt
wurde. Heute ist bekannt, dass die Masse auch geringfügig abnehmen kann,
während gleichzeitig Energie nach E = mc² (Albert Einstein) freigesetzt
wird, auch wenn dies bei chemischen Reaktionen noch nicht mit Waagen messbar
ist. Doch so weit wollen wir zunächst nicht gehen. Die hier vorgestellten
Demonstrationen eignen sich als Vorbereitung für das Thema Oxidation.
Dass bei chemischen Reaktionen nichts von der Masse der beteiligten Stoffe verloren geht, ist nicht unbedingt eine primäre Alltagserfahrung. Beim Verbrennen einer Kerze sieht man zunächst, wie das Wachs immer weniger und die Kerze „leichter“ wird. Zum Einstieg in die Problematik wird eine Kerze auf eine Waage gestellt. Nun äußern die Schüler Vermutungen, wie sich die Waage verändern wird. Sie versuchen die Vermutungen zu begründen. Alternativ dazu könnte eine Kerze auf eine digitale Waage mit einer Messgenauigkeit von 0,001 Gramm gestellt werden.
Beim Verbrennen wird
die Kerze leichter, dies entspricht in der Regel auch den genannten Erwartungen.
Was aber wird aus der fehlenden Masse? Haben die Schülerinnen und Schüler bei den davor durchgeführten
Experimenten mit der Kerze genau aufgepasst, dann
vermuten sie, dass beim Verbrennen von Wachsdampf
zunächst Ruß entsteht, der in der leuchtenden Zone zu Kohlenstoffdioxid
verbrennt.
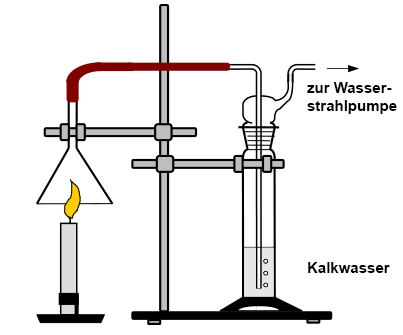
Dieses Gas kann durch
das Absaugen mit einem Trichter und einer Wasserstrahlpumpe in eine
Gaswaschflasche
mit Kalkwasser geleitet werden, wobei eine Trübung auftritt. Doch
wo kommt das Kohlenstoffdioxid normalerweise vor? Die Lehrkraft
bläst
ausgeatmete Luft aus der Lunge in einen Luftballon und lässt sie
dann mit einem Glasröhrchen durch Kalkwasser in einem Reagenzglas
strömen.
Das Kalkwasser trübt sich ebenfalls.
Im Anschluss daran wird gezeigt, dass das Verbrennungsgas der Kerze eine feststellbare Masse besitzt. Man füllt Seifenblasen mit Kohlenstoffdioxid aus der Gasflasche und lässt diese an den Boden fallen. Mit etwas Fingerspitzengefühl gelingt eine weitere, wunderschöne Demonstration: Ein Behälter aus Glas oder aus Plexiglas, beispielsweise ein kleineres Aquarium, wird mit einer Glasplatte abgedeckt. Dann füllt man mit einem Schlauch vorsichtig Kohlenstoffdioxid aus der Gasflasche in den Behälter bis er ganz voll gefüllt ist. Nun zieht man die Glasplatte vorsichtig ab und stellt Seifenblasen aus Luft her, die in den Behälter „gelegt“ werden. Die Seifenblasen schwimmen wie von Zauberhand abgebremst auf dem unsichtbaren (schwereren) Kohlenstoffdioxid. Der Versuch gelingt nur, wenn im Raum keine Luftbewegungen vorhanden sind: Türen und Fenster geschlossen halten! Raumlüftung ausschalten! Die Demonstration verdeutlicht, dass das Kohlenstoffdioxid schwerer als Luft ist und eine Masse besitzt.
Taucht man eine Kerze
in den Behälter, geht sie aus. Der gleiche Effekt kann auch dadurch
verdeutlicht werden, in dem man mehrere Kerzen auf unterschiedlich hohen
Treppenstufen in den mit Luft gefüllten Behälter stellt und danach
das Kohlenstoffdioxid einleitet.
Möglicher Erklärungsversuch:
Beim Verbrennen von Kerzenwachs entsteht als Verbrennungsgas Kohlenstoffdioxid,
das eine feststellbare Masse besitzt und die Verbrennung nicht mehr unterhält.
Wir vermuten, dass der Hauptanteil der beim Verbrennen der Kerze „verlorenen“ Masse in dem Kohlenstoffdioxid vorhanden ist.
Demonstration 2 Dichtebestimmung mit Gaswägekugel und Kolbenprober Sicherheit: Bei Versuchen mit einem Vakuum müssen alle Beteiligten eine Schutzbrille tragen. Die ausführende Person trägt zusätzlich Schutzhandschuhe. Bei einer Implosion besteht Splittergefahr!  Hat man eine 100ml-Gaswägekugel zur Verfügung, pumpt man mit einer Handpumpe nicht mehr als 500 mbar aus der Kugel und wiegt diese dann auf 0,001 g genau. Bei einer 250ml-Gaswägekugel dürfen bei der Verwendung eines 100ml-Kolbenprobers nicht mehr als 200 mbar abgesaugt werden! Die Wägung erfolgt stets auf einem dicken Korkring, damit ein gewisser Abstand von der Kugel zur Wägeschale gewährleistet ist. Die Kugel darf nicht angefasst werden, weil jede zugeführte Wärme die Messung massiv beeinflusst.  Dann verbindet man die Kugel über ein kurzes Siliconschlauchstück mit einem Kolbenprober mit Hahn, der 100 ml des zu prüfenden Gases enthält. Durch vorsichtiges Öffnen der beiden Hähne gelangt das Gas in die Kugel, während man gleichzeitig das in die Gaswägekugel eingeströmte Gasvolumen durch die Volumenabnahme am Kolbenprober ablesen kann. Bei der erneuten Wägung ergibt sich eine Differenz. Auf diese Art und Weise lässt sich die Masse (und Dichte) von Luft und auch eines Gases wie Kohlenstoffdioxid annähernd genau bestimmen.  Hinweise: Viele Gaswägekugeln haben nur sehr ungenau das angegebene Volumen. Die Gasbestimmung funktioniert nur nach der oben beschriebenen Methode unter Zuhilfenahme eines Kolbenprobers. Die Messung gelingt auch mit einem gewöhnlichen Rundkolben, auf den ein durchbohrter Stopfen mit Hahn gesteckt wird. Hat man auch keinen Kolbenprober zur Verfügung, kann man in den evakuierten Rundkolben vorsichtig Wasser einströmen lassen. Das Wasservolumen entspricht dem abgepumpten Gasvolumen. Das Wasservolumen im Rundkolben lässt sich danach in einem 100ml-Messzylinder relativ genau messen.
Achtung: Diese Demonstration
darf nur mit Reagenzgläsern aus Quarzglas und mit Schutzbrille durchgeführt
werden. In einem bekannten Fall verlor eine Lehrerin ihr Augenlicht, weil
das Reagenzglas platzte! Der Ballon wird vor der Durchführung des
Versuchs zur Dehnung mehrmals aufgeblasen und wieder entspannt. Für
exaktere Ergebnisse verwendet man zwei ineinander gestülpte Ballons.
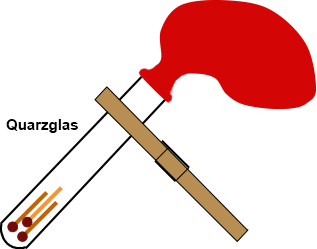
Stülpt man den Luftballon
über ein Reagenzglas, in dem sich drei Streichhölzer befinden,
dann lassen sich die Verbrennungsgase beim Abbrennen der Streichhölzer
auffangen und mit einer Präzisionswaage wiegen. Der Versuch wird zuerst
ohne Ballon vorgeführt. Man wiegt das Reagenzglas mit den Streichhölzern
vor und nach dem Abrennen der Streichhölzer. Mit einem Brenner erhitzt
man das Reagenzglas, bis die Streichhölzer zünden.
Dann wird der Ballon auf das Reagenzglas gestülpt, so dass es dicht verschlossen ist. Wieder äußern die Schüler Vermutungen, was passieren wird, wenn jetzt Wägungen erfolgen. Wie ändert sich die Masse, wenn die Streichhölzer im Reagenzglas ohne Ballon gezündet werden und wie mit Ballon? Die Ergebnisse werden diskutiert und auf mögliche Fehlerquellen untersucht. Auch wenn das geschlossene System mit Ballon nach der chemischen Reaktion seine Masse deutlich besser erhält, als das System ohne Ballon, kann es sein, dass die Waage trotz des scheinbar geschlossenen Systems immer noch eine geringere Masse anzeigt. Wo liegen die möglichen Fehler?
Ausblick:
Die genauen Vorgänge bei einer Verbrennung
werden erst beim Thema Oxidation behandelt.
Die Fragestellung, was mit der Masse passiert, wird dort nochmals aufgegriffen.
Führt man das Gesetz der konstanten Massenverhältnisse nach Proust
und das Volumengesetz von Gay-Lussac mit Hilfe von Knallgasreaktionen
im Eudiometer ein, dann sollte das Gesetz der Massenerhaltung auf
jeden Fall bekannt sein.
|