Kohlenwasserstoffe
| Inhalt Unterteilung Alkane Alkene Alkine Cyclische und aromatische | 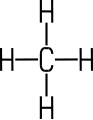 Methan | Die Kohlenwasserstoffe stellen die einfachste Stoffgruppe
der organischen Chemie dar. Sie sind nur aus Kohlenstoff- und
Wasserstoff-Atomen aufgebaut. Der einfachste Vertreter ist Methan, das
den Hauptbestandteil des Erdgases ausmacht. |
Unterteilung der Kohlenwasserstoffe
Zu den Kohlenwasserstoffen (KW) gehört eine Gruppe von chemischen Verbindungen, die aus Kohlenstoff- und Wasserstoff-Atomen aufgebaut sind. Sie kommen in den fossilen Energieträgern in großer Zahl und Vielfalt vor. Beim Verbrennen der Kohlenwasserstoffe werden die Kohlenstoff-Atome zu Kohlenstoffdioxid und die Wasserstoff-Atome zu Wasser oxidiert.
Nach der Art ihrer Struktur werden die Kohlenwasserstoffe in Untergruppen unterteilt: Aliphatische
Kohlenwasserstoffe sind aus Kohlenstoff- und Wasserstoff-Atomen zusammengesetzt und enthalten keine aromatischen Bindungen. Die aromatischen Kohlenwasserstoffe enthalten dagegen mindestens einen aromatischen Ring. Ihr einfachster Vertreter ist Benzol.
Acyclische Kohlenwasserstoffe sind in geraden oder verzweigten Ketten miteinander verbunden. Zu dieser Untergruppe gehören beispielsweise die Alkane, die Alkene und die Alkine. Cyclische Kohlenwasserstoffe wie Cyclohexan oder Cyclohexen enthalten ringartige, nichtaromatische Bindungen.
Kohlenwasserstoffe wie Ethan, die nur Einfachbindungen zwischen den Kohlenstoff-Atomen enthalten, gehören zu den gesättigten Kohlenwasserstoffen. Im Gegensatz dazu zählen Kohlenwasserstoffe wie Ethen oder Ethin mit Doppel- oder Dreifachbindungen zu den ungesättigten Kohlenwasserstoffen.
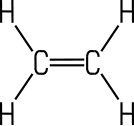
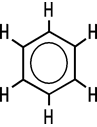
Alkane | Aliphat | Aliphat | Aromat | Aromat |
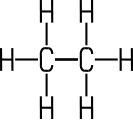 |  |  | 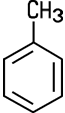 |
| Ethan |
Ethen | Benzol | Toluol |
Acyclische Kohlenwasserstoffe sind in geraden oder verzweigten Ketten miteinander verbunden. Zu dieser Untergruppe gehören beispielsweise die Alkane, die Alkene und die Alkine. Cyclische Kohlenwasserstoffe wie Cyclohexan oder Cyclohexen enthalten ringartige, nichtaromatische Bindungen.
| Acyclischer KW | Acyclischer KW | Cyclischer KW | Cyclischer KW |
 |  | 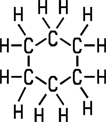 | 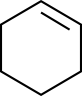 |
| Methan |
Ethen | Cyclohexan | Cyclohexen |
Kohlenwasserstoffe wie Ethan, die nur Einfachbindungen zwischen den Kohlenstoff-Atomen enthalten, gehören zu den gesättigten Kohlenwasserstoffen. Im Gegensatz dazu zählen Kohlenwasserstoffe wie Ethen oder Ethin mit Doppel- oder Dreifachbindungen zu den ungesättigten Kohlenwasserstoffen.
| Gesättigter KW | Ungesättigter KW | Ungesättigter KW | Ungesättigter KW |
 |  |  | |
| Ethan | Ethen | Ethin | Cyclohexen |
Die Benennung der einzelnen Stoffe ist durch die internationale
IUPAC-Nomenklatur festgelegt. Alkane sind gesättigte Kohlenwasserstoffe mit C-C-Einfachbindungen. Die Familie der Alkane ist an der Endung -an zu erkennen. Methan ist der einfachste Vertreter, ein Methan-Molekül ist aus einem
Kohlenstoff-Atom im Zentrum und vier Wasserstoff-Atomen aufgebaut. Ergänzt
man im Methan-Molekül ein weiteres Kohlenstoff-Atom, erhält man
ein Alkan mit zwei Kohlenstoff-Atomen und sechs Wasserstoff-Atomen. Auf
diese Art und Weise lässt sich die homologe
Reihe der Alkane darstellen:
| C-Atome | 1 | 2 | 3 | 4 |
 |
 |
 |
 |
|
| Valenz- strich- formel |
 |
 |
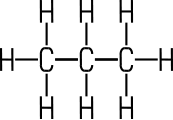 |
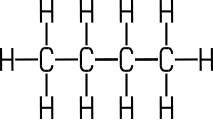 |
| Skelett- formel |
nicht darstellbar |
|||
| Summen- formel |
CH4 | C2H6 | C3H8 | C4H10 |
| Name | Methan | Ethan | Propan | Butan |
Aus dieser Reihe ergibt
sich für die Alkane die allgemeine Summenformel nach dem Verknüpfungsgesetz CnH2n+2. Ab fünf
Kohlenstoff-Atomen ist der Name der Alkane von den griechischen Zahlwörtern
abgeleitet. Ab dem Butan tritt Stellungs-Isomerie auf.
Eigenschaften der Alkane
Mit zunehmender Kettenlänge steigen die Siedetemperaturen der Alkane. Die ersten vier sind gasförmig, danach sind sie flüssig und werden bei langen Kettenlängen und steigender Molekülmasse zunehmend zähflüssig. Sie liegen etwa ab dem Hexadecan bei Raumtemperatur im festen Zustand vor. Die langkettigen Kohlenwasserstoffe dieser Reihe ab dem Pentadecan kommen im Paraffin vor. Es existieren Paraffine mit bis zu 50 Kohlenstoff-Atomen in einer Reihe.
Mit zunehmender Kettenlänge steigen die Siedetemperaturen der Alkane. Die ersten vier sind gasförmig, danach sind sie flüssig und werden bei langen Kettenlängen und steigender Molekülmasse zunehmend zähflüssig. Sie liegen etwa ab dem Hexadecan bei Raumtemperatur im festen Zustand vor. Die langkettigen Kohlenwasserstoffe dieser Reihe ab dem Pentadecan kommen im Paraffin vor. Es existieren Paraffine mit bis zu 50 Kohlenstoff-Atomen in einer Reihe.
| Name | Summenformel | Schmelzpunkt | Siedepunkt | Flammpunkt |
| Methan | CH4 | −182 °C | −161 °C | |
| Ethan | C2H6 | −183 °C | −89 °C | −135 °C |
| Propan | C3H8 | −188 °C | −42 °C | −104 °C |
| Butan | C4H10 | −138 °C | −0,5 °C | −60 °C |
| Pentan | C5H12 | −130 °C | +36 °C | −49 °C |
| Hexan | C6H14 | −95 °C | +69 °C | −23 °C |
| Heptan | C7H16 | −91 °C | +98 °C | −4 °C |
| Octan | C8H18 | −57 °C | +126 °C | +12 °C |
| Nonan | C9H20 | −53 °C | +151 °C | +31 °C |
| Decan | C10H22 | −30 °C | +174 °C | +46 °C |
| Dodecan | C12H26 | −12 °C | +215 °C | +74 °C |
| Pentadecan | C15H32 | +9 °C | +270 °C | +122 °C |
| Hexadecan | C16H34 | +18 °C | +287 °C | +135 °C |
| Heptadecan | C17H36 | +22 °C | +302 °C | +155 °C |
Die
steigenden Siedetemperaturen lassen sich aufgrund der steigenden Kräfte,
die zwischen den Molekülen wirksam sind, erklären. Bei kleineren
Molekülen sind die zwischenmolekularen Anziehungskräfte relativ
schwach. Sie können daher leichter verdampfen. Mit zunehmender Molekülmasse
steigen diese Kräfte, die auch als Van-der-Waals-Kräfte bezeichnet werden. Ab Heptadecan liegt ein fester Aggregatzustand vor. Paraffinöl ist ein Gemisch langkettiger
Alkane. Festes Paraffin ist eine feste, durchscheinende, weiße Masse
mit einer Schmelztemperatur von 50 bis 60 °C.
Mit steigender Kettenlänge steigt auch der Flammpunkt der Alkane. Die kurzkettigen Alkane sind extrem entzündbare Gase. Mit Luft oder mit Sauerstoff bilden sich explosionsgefährliche Gemische. Langkettige Alkane entflammen dagegen erst, wenn sie erhitzt werden, das ist zum Beispiel beim Paraffinöl der Fall. Je länger die Kette, umso mehr rußt die Flamme, da die langkettigen Alkane nur unvollständig verbrennen.
Mit steigender Kettenlänge steigt auch der Flammpunkt der Alkane. Die kurzkettigen Alkane sind extrem entzündbare Gase. Mit Luft oder mit Sauerstoff bilden sich explosionsgefährliche Gemische. Langkettige Alkane entflammen dagegen erst, wenn sie erhitzt werden, das ist zum Beispiel beim Paraffinöl der Fall. Je länger die Kette, umso mehr rußt die Flamme, da die langkettigen Alkane nur unvollständig verbrennen.
Alkane weisen keine Polarität auf und sind daher nicht wasserlöslich; sie sind „hydrophob“ oder dem Wasser abgeneigt. Ihre Dichte ist geringer als Wasser, daher schwimmen
die Alkane auf dem Wasser. Untereinander sind sie gut löslich und
bilden eine klare Lösung. Sie lösen sich in allen unpolaren Lösungsmitteln; sie sind „lipophil“ oder dem Fett zugeneigt. Benzin stellt ein Gemisch verschiedener Alkane dar. Es ist
nicht wasserlöslich, schwimmt auf dem Wasser und löst alle Alkane.
Vorkommen und Gewinnung der Alkane
Die Alkane kommen in
großer Vielzahl im Erdöl vor. Man gewinnt sie durch die fraktionierte
Erdöldestillation. Gemische von Pentan bis Heptan werden als Leichtbenzine bezeichnet, sie kommen im normalen Autobenzin vor. Gemische mit acht bis zehn
Kohlenstoff-Atomen nennt man Schwerbenzine. Im Diesel oder im Heizöl kommen Alkane mit bis zu zwölf Kohlenstoff-Atomen vor. Die langkettigen Paraffine werden als Lampenöl oder als Kerzenwachs verwendet.
Substitutionsreaktion der Alkane
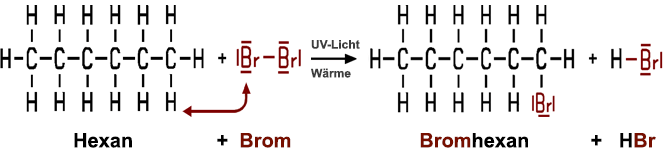
Vermischt man in einem Reagenzglas ein Alkan wie Hexan mit Bromwasser, löst sich das Brom nach dem Schütteln mit gelber Farbe im Hexan. Durch Erwärmen alleine lässt sich keine weitere Reaktion erreichen. Erst beim Erwärmen und Bestrahlen mit UV-Licht tritt eine Reaktion ein, und das Bromwasser entfärbt sich. Das energiereiche UV-Licht und die Wärme erzeugen aus dem molekularen Brom einige Brom-Radikale Br•, die das Hexan-Molekül angreifen können:
Radikalbildung durch UV-Licht und Wärme: Br2
In der Gesamtreaktion reagiert das Hexan mit dem Brom zu Bromhexan und Bromwasserstoff HBr. Bromhexan gehört zur Familie der Halogenkohlenwasserstoffe. Bei einer Substitutionsreaktion werden Atome oder Atomgruppen ausgetauscht (von engl. substitute, ersetzen). In unserem Beispiel wird ein Br-Atom mit einem H-Atom durch eine radikalische Substitution (SR) getauscht:
Alkene und Alkine
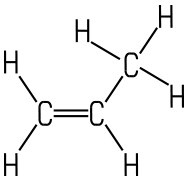
Alkene erkennt man an der C=C-Doppelbindung. Die homologe Reihe der Alkene ergibt sich nach dem Verknüpfungsgesetz CnH2n. Die physikalischen Eigenschaften der Alkene entsprechen in etwa den Alkanen. Ethen- und Ethin-Luftgemische sind aber sehr explosiv. Alkene, die zwei Doppelbindungen besitzen, erhalten die Endung -diene, Alkene mit drei Doppelbindungen die Endung -triene. Alkine sind an einer Dreifachbindung zu erkennen, ihr einfachster Vertreter ist Ethin (Verknüpfungsgesetz CnH2n-2).
| Alken mit 2 C-Atomen | Alken mit 3 C-Atomen | Alkin mit 2 C-Atomen |
 |
 |
 |
 |
 |
|
| Ethen | Propen | Ethin |
Die
Alkene und die Alkine gehören zu den ungesättigten
Kohlenwasserstoffen: Die Doppel- und Dreifachbindungen der Alkene und Alkine sind relativ instabil
und können leicht aufgebrochen werden. Leitet man Ethen durch Bromwasser, entfärbt sich das Bromwasser schnell, ohne dass
UV-Licht benötigt wird (>Nachweis einer C=C-Mehrfachbindung).
In einer Additionsreaktion
addieren sich Atome oder Molekülgruppen
an ein bestehendes Molekül. Besonders aufnahmefähig
sind ungesättigte Zweifach- oder Dreifachbindungen. In unserem
Beispiel wird die Zweifachbindung
im Ethen aufgebrochen und zwei Brom-Atome addieren sich an das
Molekül,
so dass man den Halogenkohlenwasserstoff Dibromethan erhält:
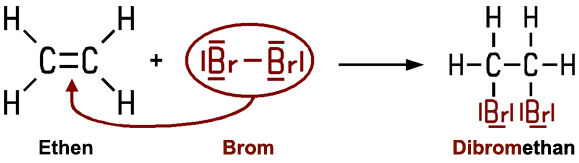
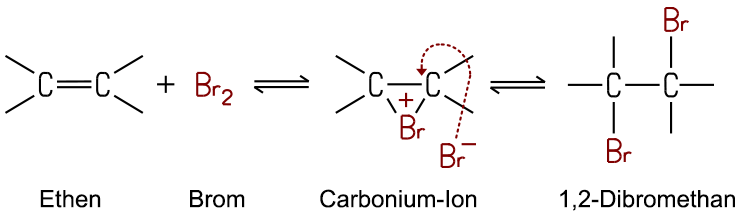
Zum genaueren Verständnis wird der Reaktionsmechanismus erläutert: Das Brom-Molekül Br2 geht eine Wechselwirkung
mit der Doppelbindung im Alken ein und wird selbst dabei polarisiert.
Das entstehende elektrophile Bromonium-Ion Br+ vermag die
Doppelbindung aufzureißen, in dem es sich an die Bindung addiert
und mit den Kohlenstoff-Atomen ein positiv geladenes Carbonium-Ion bildet. Das nucleophile Bromid-Ion Br− sucht
die Bindung am elektrophilen Carbonium-Ion und addiert sich ebenfalls in
das Molekül. Da die Reaktion durch das elektrophile Bromonium-Ion
eingeleitet wird, handelt es sich hier um eine elektrophile Addition (AE).

Cyclische und aromatische Kohlenwasserstoffe
Bei den cyclischen
Kohlenwasserstoffen ordnen sich die Kohlenstoff-Atome ringförmig
an. Bei ihnen lassen sich die Elektronenpaarbindungen eindeutig zuordnen. Bei den aromatischen Kohlenwasserstoffen wie Benzol
lassen sich die Doppelbindungen im Ring nicht mehr eindeutig zuordnen,
die Elektronen sind delokalisiert.
Cycloalkane und Cycloalkene als Beispiel für cyclische Kohlenwasserstoffe
Beim Cyclohexan, dem
bekanntesten Vertreter dieser Gruppe, bilden sechs Kohlenstoff-Atome einen
Ring. Cyclohexan bildet zwei Konformations-Isomere.
Chemisch sind die Cycloalkane relativ reaktionsträge, weshalb sie
als Lösungsmittel gut verwendet werden können. Sie kommen ebenfalls
im Erdöl vor und wurden früher aufgrund ihrer Herkunft als "Naphthene"
bezeichnet. Cycloalkene wie Cyclohexen enthalten Doppelbindungen im Kohlenstoff-Ring.
| Cyclischer KW | Aromatischer KW | Aromat mit Methylgruppe |
 |
 |
 |
 |
 |
 |
| Cyclohexan | Benzol | Toluol |
Aromatische Kohlenwasserstoffe, Aromaten
Der Begriff der Arene oder der Aromaten leitet sich vom aromatischen Geruch des Benzols ab. Im Benzol-Molekül
lassen sich die bindenden Elektronen nicht mehr eindeutig einem Atom zuordnen,
sie sind delokalisiert. Die dadurch zwischen den Ring-Bindungen vorkommenden,
ringförmigen Elektronenwolken werden mit einem Kreis dargestellt.
Diese Schreibweise geht auf Robert Robinson (1886–1975) zurück: Benzol ist eine aromatisch riechende, farblose Flüssigkeit, die im Erdöl
und in der Steinkohle vorkommt. Sie ist nicht wasserlöslich und nur
mit unpolaren Lösungsmitteln vermischbar. Benzol ist krebserzeugend
und kann genetische Defekte verursachen. Die Flüssigkeit verbrennt mit stark rußender
Flamme. Das ebenfalls giftige und im
Erdöl vorkommende Toluol (Methylbenzol)
besitzt neben dem Benzol-Ring eine CH3-Gruppe.
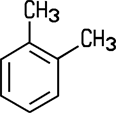
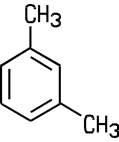
Um Reaktionen in der organischen Chemie korrekt darstellen zu können, verwendet man bei den aromatischen Verbindungen überwiegend die Kekulé-Schreibweise. Sie ist benannt nach August Kekulé (1829–1896) und stellt wieder die Einfach- und Doppelbindungen dar. Vom Xylol existieren drei Isomere:
Um Reaktionen in der organischen Chemie korrekt darstellen zu können, verwendet man bei den aromatischen Verbindungen überwiegend die Kekulé-Schreibweise. Sie ist benannt nach August Kekulé (1829–1896) und stellt wieder die Einfach- und Doppelbindungen dar. Vom Xylol existieren drei Isomere:
| o-Xylol | m-Xylol | p-Xylol |
 |
 |
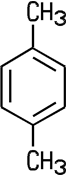 |
| 1,2-Dimethylbenzol | 1,3-Dimethylbenzol | 1,4-Dimethylbenzol |
Der Name -methyl leitet sich vom Methan ab und kennzeichnet die CH3-Atomgruppe.
Sind an den Benzol-Ring zwei Methyl-Gruppen angehängt, wie beim Xylol,
dann erhält die Verbindung den Namen -dimethyl. Die Ziffern zu Beginn der Namen kennzeichnen
die Stellungen der Methyl-Gruppen. Das im Handel erhältliche Xylol
besteht aus einem Gemisch dieser drei Isomere.
Es wird als Zusatz im Autobenzin, in der Lackindustrie und als Lösungsmittel
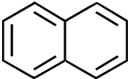
verwendet. Es existieren auch aromatische Kohlenwasserstoffe mit mehreren Ringen. Ein Naphthalin-Molekül
ist zum Beispiel aus zwei Ringen aufgebaut. Naphthalin bildet Blättchen, die schon
bei Zimmertemperatur sublimieren. Es wurde früher in Mottenkugeln
eingesetzt. Heute ist diese Anwendung nicht mehr erlaubt, da Naphthalin im Verdacht steht, Krebs zu erzeugen.
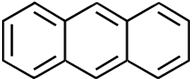
| Naphthalin | Paranaphthalin | Benzo(a)pyren |
 |
 |
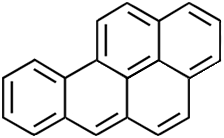 |
| Naphthalen | Anthracen | Benzo[a]chrysen |
Anthracen ist ein Ausgangsstoff
zur Herstellung von Farbstoffen, beispielsweise zur Alizarinsynthese, einem
Farbstoff, der in der Natur in der Krappwurzel vorkommt. Ein Anthracen-Molekül ist aus drei Ringen aufgebaut. Ein besonders
krebserzeugender Kohlenwasserstoff stellt das aus fünf Ringen aufgebaute
Benzo(a)pyren dar. Es kommt im Teer und im Zigarettenrauch vor und
begünstigt das Entstehen von Lungenkrebs.
Buch individuell erstellen: Basis-Text Kohlenwasserstoffe


> Inhaltsverzeichnis
Buch individuell erstellen: Basis-Text Kohlenwasserstoffe


> Inhaltsverzeichnis