Die technische Nutzbarmachung
der Elektrizität geht möglicherweise bis zu den alten Ägyptern
zurück. Ob die Ägypter tatsächlich die Elektrolyse und Batterien
einsetzten, ist noch umstritten. Wahrscheinlich kannten sie aber das Phänomen
der elektrischen Entladung und konnten dies in Experimenten zeigen. Der
italienische Arzt Luigi Galvani (1737–1798) entdeckte um 1790 das Phänomen,
dass die Muskeln von präparierten Froschschenkeln zuckten, wenn sie
gleichzeitig mit einem Eisen- und Kupfergegenstand berührt wurden,
sofern die Metalle miteinander verbunden waren. Galvani kannte die genauen
Zusammenhänge damals noch nicht, aber nach ihm wurde die galvanische
Zelle benannt. Die erste Batterie entwickelte der italienische Physiker
Alessandro Volta (1745–1827):
Aufbau einer Voltasäule und altes Originalmodell,
im Hintergrund Galvani mit den Froschschenkel-Experimenten
Die von Volta um 1800
erfundene Voltasäule ist aus vielen Lagen
übereinandergeschichteter Elemente aufgebaut. Ein Element besteht
aus einer Kupfer- und einer Zinkplatte, dazwischen befindet sich Textilstoff,
der mit Säure oder einer Salzlösung getränkt ist. Die Batterie
ermöglichte erstmals den Betrieb einer kontinuierlichen Stromquelle,
so dass viele weitere Experimente mit der Elektrizität durchgeführt
werden konnten. Um 1802 brachte William Cruickshank in Schottland die Trog-Batterie
in Massenproduktion auf den Markt, die eine verbesserte Version der Volta-Batterie
darstellte.
Die Funktionsweise einer
Batterie beruht auf dem unterschiedlichen
elektrochemischen Potenzial zweier Halbzellen.
Steckt man beispielsweise ein Kupferblech und ein Zinkblech in eine Zitrone
oder einen Apfel, erhält man eine galvanische
Zelle. Die saure Lösung in der Zitrone wirkt als Elektrolyt. Sobald
man die Elektroden mit einem Verbraucher verbindet, fließt ein elektrischer
Strom, der einen kleinen Solarmotor antreiben kann.
Der Lösungsdruck an der Zinkelektrode ist größer als an der Kupferelektrode, da Zink ein unedleres Metall ist. Das Zink wird eher oxidiert als das Kupfer, es entstehen am Zink Elektronen, die zum Kupferblech fließen. Die Zinkelektrode als Ort der Oxidation funktioniert als Anode und ist bei dieser Batterie der Minuspol. Enthält das Kupferblech noch Kupferoxid auf der Oberfläche, werden zunächst die Kupfer-Ionen aus dem Kupferoxid reduziert. Diese Reaktion an der Kathode ist aber nur eine unbedeutende Nebenreaktion:
Sind die Kupfer-Ionen aus dem Kupferoxid aufgebraucht, werden am Kupferblech, das als Kathode funktioniert, Hydronium-Ionen aus dem Zitronensaft reduziert. Diese Säurekorrosion findet in der Zitronenbatterie statt, sie stellt aber auch nicht die Haupt-Reaktion an der Kathode dar:
Der Lösungsdruck an der Zinkelektrode ist größer als an der Kupferelektrode, da Zink ein unedleres Metall ist. Das Zink wird eher oxidiert als das Kupfer, es entstehen am Zink Elektronen, die zum Kupferblech fließen. Die Zinkelektrode als Ort der Oxidation funktioniert als Anode und ist bei dieser Batterie der Minuspol. Enthält das Kupferblech noch Kupferoxid auf der Oberfläche, werden zunächst die Kupfer-Ionen aus dem Kupferoxid reduziert. Diese Reaktion an der Kathode ist aber nur eine unbedeutende Nebenreaktion:
| Oxidation (Anode) | Zn |
| Reduktion (Kathode) | Cu2+ +
2 e− |
Sind die Kupfer-Ionen aus dem Kupferoxid aufgebraucht, werden am Kupferblech, das als Kathode funktioniert, Hydronium-Ionen aus dem Zitronensaft reduziert. Diese Säurekorrosion findet in der Zitronenbatterie statt, sie stellt aber auch nicht die Haupt-Reaktion an der Kathode dar:
| Oxidation (Anode) | Zn |
| Reduktion (Kathode) | 2 H3O+ +
2 e− |
In der
Zitronenbatterie ist noch eine weitere Reaktion möglich. Die Reduktion von Sauerstoff ist definitiv die
Haupt-Reaktion an der Kathode:
Statt Kupfer könnte man auch Platin oder ein anderes edles Metall nehmen, das als Kathode funktioniert. Der Erklärungsversuch zur Zitronenbatterie kann auch zur Erklärung der Volta-Säule herangezogen werden.
| Oxidation (Anode) | 2 Zn |
| Reduktion (Kathode) | O2 + 4 H3O+ + 4 e− |
Statt Kupfer könnte man auch Platin oder ein anderes edles Metall nehmen, das als Kathode funktioniert. Der Erklärungsversuch zur Zitronenbatterie kann auch zur Erklärung der Volta-Säule herangezogen werden.
Primärzellen, Batterien
Der französische
Chemiker Georges Leclanché (1839–1882) ließ im Jahre 1866
sein Leclanché-Element patentieren,
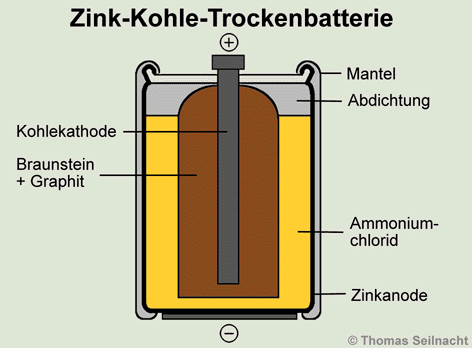
das als Vorläufer der Zink-Kohle-Trockenbatterie
gilt. Diese ist aus einer Zink-Elektrode (Anode, Minuspol) und einer Kohle-Elektrode
(Kathode, Pluspol) aufgebaut. Ein besonderes Merkmal der Trockenbatterie
ist, dass der Elektrolyt Ammoniumchlorid auf Trägermaterialien wie
Papier, Stärke, Mehl, Kleister oder Gelatine aufgezogen ist und im
Vergleich zum Daniell-Element keine flüssigen
Lösungen vorliegen. Die außenliegende Zink-Anode hat nach innen
Kontakt zu einer Papphülle, die mit 20%iger Ammoniumchlorid-Lösung
getränkt ist. Die Kohle-Kathode sitzt in einem Becher, der mit einem
Gemisch aus Braunstein- und Graphitpulver
gefüllt ist.
| Oxidation | Zn |
| Reduktion | 2 MnO2
+ 2 H2O + 2 e− |
| Reaktion 1: | OH−
+ NH4+ |
| Reaktion 2: | Zn2+ +
2 Cl− + 2 NH3 |
Reaktion 1: Die OH−-Ionen
reagieren mit den Ammonium-Ionen des Elektrolyten, so dass Ammoniak- und
Wasser-Moleküle entstehen. Reaktion 2: Zwei Ammoniak-Moleküle reagieren mit den Chlorid- und Zink(II)-Ionen. Dabei bildet sich der Komplex
Diamminzink(II)-chlorid, das als weißes, lockeres Pulver vorliegt.
Die Spannung einer Zink-Kohle-Batterie oder eines Leclanché-Elements
beträgt etwa 1,5 Volt.
Komplette und aufgeschnittene Zink-Kohle-Trockenbatterie,
bei dieser 3-Volt-Batterie sind zwei Elemente in Reihe geschaltet
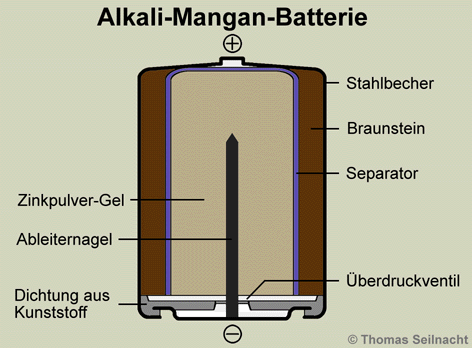
Die Alkali-Mangan-Batterie stellt eine Weiterentwicklung der Zink-Kohle-Trockenbatterie dar, die lange Zeit als Taschenlampenbatterie eingesetzt wurde. Um das Jahr 1960 entwickelte das Chemieunternehmen Union Carbide Corporation in den USA die leistungsfähige und haltbare Alkali-Mangan-Batterie. Der wesentliche Unterschied zur Trockenzelle besteht in der Verwendung eines alkalischen Elektrolyten und eines Zink-Gels statt eines Zinkbechers. Der dünne Separator besteht aus Zellstoff, Bindemitteln und einer zinkoxidhaltigen, hochprozentigen Kalilauge, er trennt die dicken Elektroden aus Zinkpulver-Gel und Braunstein (Mangan(IV)-oxid). Die Elektroden sind ebenfalls mit Kalilauge versetzt. Bei einem Kurzschluss oder bei Überhitzung entsteht ein Überdruck, der die Alkali-Mangan-Batterie zum Bersten bringen kann. Daher ist in die Kunststoff-Dichtung der Batterie am Boden eine dünne Schicht eingebaut, die als Überdruckventil dient. Die Batterie liefert eine Spannung von etwa 1,5 Volt. Bei einer 9-Volt-Blockbatterie sind sechs Zellen in Reihe geschaltet.
Zahlreiche Geräte
der Elektronik benötigen heute Batterien in kleinen Dimensionen, sogenannte
Knopfzellen kommen zum Einsatz. Für Hörgeräte
und Belichtungsmesser in Kameras entwickelte man in den 1960er Jahren
die Zink-Quecksilberoxid- Knopfzelle. Sie
enthält eine Elektrode aus Quecksilber(II)-oxid
und eine aus Zinkpulver, sowie einen alkalischen Elektrolyten wie verdünnte
Kalilauge. Die Spannung von 1,35 Volt
wird konstant abgegeben. Beim Gebrauch der Batterie wird das Quecksilberoxid
zu Quecksilber reduziert. Die Entsorgung des giftigen Quecksilbers
ist ein großes Problem. Die Herstellung und Verwendung von Quecksilber-Batterien
wurde daher eingestellt.
Für elektronische Geräte entwickelte man alternativ die Zink-Silberoxid-Knopfzelle. Bei dieser Batterie wird das teurere Silber(I)-oxid statt dem Quecksilber(II)-oxid eingesetzt. Sie liefert eine Spannung von 1,5 Volt. Die verfügbare Stromstärke ist auch bei kleinen Abmessungen im hohen Leistungsbereich. Als Reaktionsprodukt erhält man Silber, das wiederverwertet werden kann:
| Oxidation | Zn |
| Reduktion | Ag2O +
H2O + 2 e− |
Für Hörgeräte
kommt die Zink-Luft-Knopfzelle mit einer Spannung
von 1,4 Volt zum Einsatz, sie liefert eine äußerst konstante
Spannung über einen langen Zeitraum. Größere Zink-Luft-Batterien
werden für den Langzeiteinsatz an Baustellenbeleuchtungen im Straßenbau
eingesetzt. Als Kathode wird ein Aktivkohle-Russ-Gemisch verwendet, das
mit der Luft in Verbindung steht. Die Anode enthält Zinkpulver:
| Oxidation | 2 Zn |
| Reduktion | O2 +
2 H2O + 4 e− |
Die ebenfalls leistungsfähige
Lithium-Batterie oder genauer Lithium-Mangandioxid-Batterie
liefert aufgrund des sehr niedrigen Normalpotenzials
des Lithiums eine relativ hohe Spannung von etwa 3 Volt. Die Kathode enthält
gepulvertes Mangan(IV)-oxid, Bindemittel
sowie Ruß zur Verbesserung der Leitfähigkeit. Die Anode besteht
aus Lithium, der Elektrolyt aus Lithiumperchlorat,
das in einem wasserfreien, organischen Lösungsmittel gelöst ist.
An der Anode (Minuspol) wird das Lithium oxidiert. Aus Lithium-Atomen entstehen Lithium-Ionen. Diese werden für die Reaktionsprozesse an der Kathode benötigt. Dort bildet sich das Mischoxid Lithium-Mangandioxid.
| Oxidation | Li |
| Reduktion | Li+ +
MnO2 + e− |
Sekundärzellen, Akkumulatoren
Galvanische Zellen, die
nicht wieder aufgeladen werden können, bezeichnet man als Primärzellen.
Im Gegensatz dazu können Sekundärzellen
mit Hilfe von elektrischem Strom wieder aufgeladen werden. In den wieder aufladbaren
Akkumulatoren wird die Energie chemisch gespeichert.
Der deutsche Physiker und Mediziner Wilhelm Josef Sinsteden (1803–1891)
entwickelte um 1854 den bis heute in Kraftfahrzeugen und U-Booten verwendete Bleiakkumulator (oder Bleiakku).
Die einfachste Form eines Bleiakkus besteht aus zwei Elektroden aus Blei,
die in mit Wasser verdünnte Schwefelsäure H2SO4 • aq als Elektrolyt tauchen. Dabei entstehen an den Elektroden durch eine
chemische Reaktion Schichten aus schwer löslichem, weißem Blei(II)-sulfat PbSO4. Beim Anlegen von elektrischem Strom bildet sich
an einer Elektrode Blei Pb und an der anderen bräunliches
Blei(IV)-oxid PbO2:
Laden: 2 PbSO4 + 2 H2O
Beim Laden steigt die
Konzentration der Schwefelsäure. Beim komplett geladenen Akku hat die
Schwefelsäure eine Dichte von 1,28 Gramm pro Kubikzentimeter. Beim Entladen
läuft die Reaktion in Gegenrichtung ab, die Konzentration und die
Dichte der Säure nehmen wieder ab. Dann beträgt die Dichte nur
noch etwa 1,10 Gramm pro Kubikzentimeter. Erst durch mehrfaches Laden und Entladen
erreicht ein mit Bleiplatten bestückter Bleiakku seine volle
Leistung.
Benutzter Bleiakku: fünf Zellen aufgeschnitten und Elektrolyt entfernt,
jede Zelle enthält einen dreifachen, parallel geschalteten Plattensatz
Die käuflichen Bleiakkumulatoren
enthalten bereits Blei(IV)-oxid und fein verteiltes Blei, die beide in
gitterartigen Elektrodenplatten untergebracht sind. Daher sind die heutigen
Bleiakkus nach dem Füllen mit Schwefelsäure sofort einsatzbereit.
Die Konzentration der Schwefelsäure liegt bei der käuflichen
„Batteriesäure“ bei 30 bis 38%. Zwischen den Elektrodenplatten befinden
sich Separatoren aus PVC, die eine Berührung verhindern. Beim Entladen
oxidiert das Blei am Minuspol zu Blei(II)-sulfat, das Blei(IV)-oxid am
Pluspol wird zu Blei(II)-sulfat reduziert:
| Oxidation | Pb +
SO4 2− |
| Reduktion | PbO2 + SO4 2−
+ 4 H+ + 2 e− |
Eine Zelle liefert im
Durchschnitt eine Spannung von etwa 2 Volt. Bei einem 12-Volt-Akku sind
sechs Zellen in Reihe geschaltet. Bleiakkus zeichnen sich durch eine hohe
Stromstärke aus. Dies ist beim Starten von Fahrzeugen zwar erwünscht,
es kann aber auch bei Kurzschlüssen zu Kabelbränden, zur Funkenbildung
oder zur Überhitzung von Werkzeugen führen, wenn man mit diesen
die Elektroden berührt. Daher ist bei jedem Akkuwechsel der Minuspol
als erstes abzutrennen und gut zu isolieren.
Bei Kraftfahrzeugen wird
ein Bleiakku kontinuierlich durch die Lichtmaschine geladen. Beim Überladen
des Akkus beginnt er zu gasen, wobei Wasserstoff entsteht. Dies führt
allmählich zu einer Abnahme der Schwefelsäure. Damit der Akku
nicht kaputt geht, muss ein gasender Akku nachgefüllt werden. Auch
ein zu starkes Entladen unter 1,8 Volt kann zur Zerstörung des Bleiakkus
führen. Verbrauchte Bleiakkus müssen an einer Tankstelle oder
beim Recyclinghof abgegeben werden, damit das für Wasserorganismen
sehr giftige Blei nicht in der Umwelt freigesetzt
wird und wiederverwertet werden kann.
Der um 1900 von dem schwedischen Ingenieur Ernst Waldemar Jungner (1869–1924) entwickelte Nickel-Cadmium-Akkumulator (NiCd) stellte die nächste größere Stufe in der Entwicklung der wieder aufladbaren Batterieysteme dar. Im Gegensatz zum Bleiakku verändert sich der Elektrolyt aus 20%iger Kaliumhydroxidlösung beim Laden und Entladen nicht. Dadurch ist eine lange Lebensdauer gewährleistet. Die Elektroden bestehen aus Platten mit fein verteiltem Cadmium und mit Nickel(III)-oxidhydroxid NiO(OH) . Bei der Entladung wird das Cadmium am Minuspol zu Cadmium(II)-hydroxid oxidiert und das Nickel(III)-oxidhydroxid am Pluspol zu Nickel(II)-hydroxid reduziert:
Der um 1900 von dem schwedischen Ingenieur Ernst Waldemar Jungner (1869–1924) entwickelte Nickel-Cadmium-Akkumulator (NiCd) stellte die nächste größere Stufe in der Entwicklung der wieder aufladbaren Batterieysteme dar. Im Gegensatz zum Bleiakku verändert sich der Elektrolyt aus 20%iger Kaliumhydroxidlösung beim Laden und Entladen nicht. Dadurch ist eine lange Lebensdauer gewährleistet. Die Elektroden bestehen aus Platten mit fein verteiltem Cadmium und mit Nickel(III)-oxidhydroxid NiO(OH) . Bei der Entladung wird das Cadmium am Minuspol zu Cadmium(II)-hydroxid oxidiert und das Nickel(III)-oxidhydroxid am Pluspol zu Nickel(II)-hydroxid reduziert:
| Oxidation | Cd +
2 OH− |
| Reduktion | 2 NiO(OH) + 2 H2O
+ 2 e− |
Der Nickel-Cadmium-Akku
war im 20. Jahrhundert ein viel verwendeter Akku in elektronischen Geräten,
auch in der Weltraumfahrt wurde er häufig eingesetzt. Mit dem neuen
Batteriegesetz setzte Deutschland im Jahr 2009 ein Batteriegesetz um, das
Beschränkungen für den Einsatz des giftigen Cadmiums
in Batterien festlegt. Seither dürfen cadmiumhaltige Batterien nur
noch in Ausnahmefällen verwendet werden, beispielsweise in Alarmsystemen
oder in medizinischen Anlagen. Der Akku hat noch weitere Nachteile: Beim
Überladen beginnt er zu gasen, es bildet sich Wasserstoff und Sauerstoff.
Um dies zu verhindern, ist die Elektrode aus Cadmium überdimensioniert,
so dass der am Pluspol gebildete Sauerstoff zum Minuspol wandert und dort
bei der Oxidation des Cadmiums verbraucht wird. Nickel-Cadmium-Akkumulatoren
zeigen den berüchtigten Memory-Effekt.
Sie dürfen erst nach dem vollständigen Entladen wieder aufgeladen
werden, ansonsten verlieren sie einen erheblichen Teil ihrer Leistung dauerhaft.
Aufgeschnittener Nickel-Cadmium-Akku: Cadmium bildet die negative Elektrode,
Nickel(III)-oxidhydroxid die positive. Die in Schichten angeordneten Elektroden
werden durch Separatoren getrennt, als Elektrolyt dient Kaliumhydroxid.
Der Nickel-Metallhydrid-Akku
(NiMH) zeigt keinen Memory-Effekt, dafür aber den Lazy-Battery-Effekt:
Wird dieser Akku-Typ vor dem vollständigen Entladen aufgeladen, liefert
der Akku eine geringere Spannung. Dies kann aber durch mehrfaches Laden
und vollständiges Entladen wieder beseitigt werden. Das muss beispielsweise
dann vorgenommen werden, wenn das Handy oder die Kamera den Akku zu früh
als entladen anzeigt. Nickel-Metallhydrid-Akkus entladen sich von selbst.
Daher kommt ein Einsatz in Uhren oder in Feuermeldeanlagen nicht in Frage.
Beim Nickel-Metallhydrid-Akku wird als Elektrolyt eine 20%ige Kaliumhydroxidlösung eingesetzt. Die eine Elektrode besteht aus einem Gitternetz mit einer Metall-Legierung aus Lanthan, Nickel und Cobalt – die beim Laden Wasserstoff speichern kann – und die andere aus einer nickelhaltigen Legierung. Die Spannung liegt wie beim Nickel-Cadmium-Akku bei 1,2 Volt. Auch der innere Aufbau ähnelt dem Nickel-Cadmium-Akku. Die elektrochemischen Vorgänge beim Entladen lassen sich vereinfacht so darstellen:
Beim Nickel-Metallhydrid-Akku wird als Elektrolyt eine 20%ige Kaliumhydroxidlösung eingesetzt. Die eine Elektrode besteht aus einem Gitternetz mit einer Metall-Legierung aus Lanthan, Nickel und Cobalt – die beim Laden Wasserstoff speichern kann – und die andere aus einer nickelhaltigen Legierung. Die Spannung liegt wie beim Nickel-Cadmium-Akku bei 1,2 Volt. Auch der innere Aufbau ähnelt dem Nickel-Cadmium-Akku. Die elektrochemischen Vorgänge beim Entladen lassen sich vereinfacht so darstellen:
| Oxidation | Metallhydrid
+ 2 OH− |
| Reduktion | 2 NiO(OH) + 2 H2O
+ 2 e− |
Einen weiteren technischen
Fortschritt stellt der Lithium-Ionen-Akku
(Li-Ion) dar, der Spannungen um die 4 Volt liefert. Wie bei der Lithium-Batterie
wird ein wasserfreier, organischer Elektrolyt eingesetzt, in dem ein Lithiumsalz
gelöst ist. Der Minuspol besteht aus einer Graphitelektrode, der Pluspol
aus einer Mischung von Metallsalzen, die gerne Elektronen aufnehmen können,
beispielsweise aus Lithium-, Cobalt-, Nickel- und Manganoxiden. Beim Laden
des Akkus nehmen die Kohlenstoff-Atome im Graphit Lithium-Ionen in das Kohlenstoff-Gitter auf. Beim
Entladen werden Lithium-Ionen von den Metalloxiden eingelagert. Die Lithium-Ionen
wandern beim Laden und Entladen zwischen den Elektroden hin und her.
| Laden | Li+
+ Graphit |
| Entladen | Li+ +
Metalloxid |
Der Lithium-Polymer-Akku
(Li-Pol) besitzt die gleichen Elektroden wie ein Lithium-Ionen-Akku, dafür
besteht der Elektrolyt aus einem elektrisch leitfähigen
Polymer in Form einer gelartigen Kunststoff-Folie. Aus diesem Grund
ist nicht mehr unbedingt ein festes Gehäuse erforderlich. Dies ermöglicht
die Produktion von sehr flachen Akkus, beispielsweise für Mobiltelefone
oder für den Einsatz beim Modellbau. Der Lithium-Polymer-Akku liefert
3,7 Volt Spannung, er zeichnet sich durch seine sehr hohe Leistungsfähigkeit
aus. Nachteilig wirkt sich seine Empfindlichkeit gegenüber mechanischen
Beschädigungen oder gegenüber zu hohen oder zu niedrigen Temperaturen
aus. Bei Überladung kann sich der Akku sogar entzünden oder verpuffen.
Um dies zu verhindern, werden Separatoren aus Keramik eingesetzt. Die jeweiligen
Akkus dürfen nur mit einem passenden und geeigneten Ladegerät
aufgeladen werden.
Alle Batterien und Akku-Typen
dürfen nicht im normalen Haushaltsmüll entsorgt werden. Sie enthalten
teilweise giftige Schwermetalle. Die Metalle stellen wertvolle Rohstoffe
zur Wiederverwertung dar. Akkus und Batterien werden in Batteriesammelstellen
gesammelt, oder sie können den jeweiligen Händlern zurückgegeben
werden.
Literatur
Bröll/Friedrich/Oetken (2013): Die Zitronenbatterie, in ZS Chemie in der Schule Heft 5/62, S. 36
Buchmann Isidor: Wann wurde die Batterie erfunden? abgerufen 1/2013 auf batteryuniversity.com
Glöckner/Jansen u.a. (1994): Handbuch der experimentellen Chemie, Band 6 Elektrochemie, Köln
Hamann/Vielstich (2005): Elektrochemie, Weinheim
Hollemann/Wiberg (2007): Lehrbuch der anorganischen Chemie, Berlin/New York
Mortimer, Charles E. und Müller, Ulrich (2007): Chemie, Stuttgart
Seilnacht, Thomas und Rehm, Markus (2009): Chemische Experimente erleben, Bern
Stieger, Markus (Hrsg. 2007): Elemente, Grundlagen der Chemie für Schweizer Maturitätsschulen, Zug
Wikipedia - Internet Enzyklopädie, abgerufen 1/2013 diverse Anwendungsmöglichkeiten von Batteriesystemen
Literatur
Bröll/Friedrich/Oetken (2013): Die Zitronenbatterie, in ZS Chemie in der Schule Heft 5/62, S. 36
Buchmann Isidor: Wann wurde die Batterie erfunden? abgerufen 1/2013 auf batteryuniversity.com
Glöckner/Jansen u.a. (1994): Handbuch der experimentellen Chemie, Band 6 Elektrochemie, Köln
Hamann/Vielstich (2005): Elektrochemie, Weinheim
Hollemann/Wiberg (2007): Lehrbuch der anorganischen Chemie, Berlin/New York
Mortimer, Charles E. und Müller, Ulrich (2007): Chemie, Stuttgart
Seilnacht, Thomas und Rehm, Markus (2009): Chemische Experimente erleben, Bern
Stieger, Markus (Hrsg. 2007): Elemente, Grundlagen der Chemie für Schweizer Maturitätsschulen, Zug
Wikipedia - Internet Enzyklopädie, abgerufen 1/2013 diverse Anwendungsmöglichkeiten von Batteriesystemen