Aceton
CH3COCH3
Aceton
Propan-2-on
2-Propanon
Propan-2-on
2-Propanon
Acetone
Propan-2-one
2-Propanone
Propan-2-one
2-Propanone
Molmasse
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Brechungsindex (20°C)
Explosionsgrenzen
Flammpunkt
Zündpunkt
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Brechungsindex (20°C)
Explosionsgrenzen
Flammpunkt
Zündpunkt
58,079 g/mol
500 ml/m3 (MAK)
0,7902 g/cm3
−94,9 °C
+56,08 °C
vollständig mischbar
1,3588
2,5 bis 12,8 Vol.-% (Luft)
−20 °C
+465 °C
500 ml/m3 (MAK)
0,7902 g/cm3
−94,9 °C
+56,08 °C
vollständig mischbar
1,3588
2,5 bis 12,8 Vol.-% (Luft)
−20 °C
+465 °C
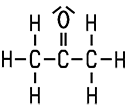
Klare, farblose Flüssigkeit

Gefahrenklassen + Kategorie
Entzündbare Flüssigkeiten 2
Schwere Augenschädig./-reizung 2
Spezifische Zielorg.-Tox. (e. ZNS) 3
Entzündbare Flüssigkeiten 2
Schwere Augenschädig./-reizung 2
Spezifische Zielorg.-Tox. (e. ZNS) 3
Aceton ist eine leicht entzündbare Flüssigkeit, die mit Luft explosive Mischungen bilden kann. Die Dämpfe dürfen nicht eingeatmet werden. Aceton darf nicht – wie leider oft üblich – in Spritzflaschen zum Lösen von Klebstoffresten offen aufbewahrt werden. Die Aufbewahrung erfolgt stets im brandsicheren Sicherheitsschrank mit laufender Luftabfuhr in einer dicht verschlossenen Glasflasche. Beim Arbeiten müssen Schutzhandschuhe aus Neopren oder Butylkautschuk getragen werden, falls die Gefahr einer größeren Hautkontamination besteht.
Wirkung auf den menschlichen Körper
Die aromatisch riechende Flüssigkeit kann auf der Haut eine rötliche Entzündung hervorrufen, die Dämpfe reizen die Bronchien und die Augen, sie verursachen Kopfschmerzen und Müdigkeit. In höheren Konzentrationen wirken sie narkotisierend. 75 Milliliter gelten als tödliche Dosis. Aceton kommt spurenweise im Harn und im Blut vor. Bei Diabetes finden sich erhöhte Konzentrationen im Harn.

Chemisch-physikalische Eigenschaften
Das Keton Aceton löst sich gut in Alkohol, Benzol und Diethylether, es ist ein gutes Lösungsmittel für Öle, Fette, Harze, Cellulose und Ethin. Mit Oxidationsmitteln wie Wasserstoffperoxid und unter Einwirkung eines Katalysators wie Salzsäure kann sich ein trimeres Peroxid bilden, das hochexplosiv ist. Mit Chloroform ist eine heftige Reaktion möglich, sofern Spuren von basisch wirkenden Stoffen vorhanden sind. Die H-Atome des Acetons lassen sich leicht durch Halogen-Atome substituieren. Mit Brom erhält man beispielsweise 1,1,1-Tribromaceton (CH3-CO-CBr3), was auch unter der Bezeichnung „Tränengas“ bekannt ist.
Die aromatisch riechende Flüssigkeit kann auf der Haut eine rötliche Entzündung hervorrufen, die Dämpfe reizen die Bronchien und die Augen, sie verursachen Kopfschmerzen und Müdigkeit. In höheren Konzentrationen wirken sie narkotisierend. 75 Milliliter gelten als tödliche Dosis. Aceton kommt spurenweise im Harn und im Blut vor. Bei Diabetes finden sich erhöhte Konzentrationen im Harn.
Chemisch-physikalische Eigenschaften
Das Keton Aceton löst sich gut in Alkohol, Benzol und Diethylether, es ist ein gutes Lösungsmittel für Öle, Fette, Harze, Cellulose und Ethin. Mit Oxidationsmitteln wie Wasserstoffperoxid und unter Einwirkung eines Katalysators wie Salzsäure kann sich ein trimeres Peroxid bilden, das hochexplosiv ist. Mit Chloroform ist eine heftige Reaktion möglich, sofern Spuren von basisch wirkenden Stoffen vorhanden sind. Die H-Atome des Acetons lassen sich leicht durch Halogen-Atome substituieren. Mit Brom erhält man beispielsweise 1,1,1-Tribromaceton (CH3-CO-CBr3), was auch unter der Bezeichnung „Tränengas“ bekannt ist.
Früher stellte man Aceton durch die trockene Destillation von Calciumacetat oder Holz her. Die technische Synthese erfolgt heute aus Isopropylalkohol durch eine katalytische Dehydrierung am Kupferkontakt bei 250 °C. Dabei werden vom Isopropylalkohol zwei Wasserstoff-Atome abgespalten:
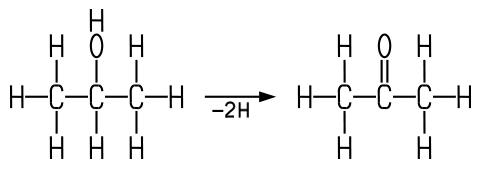
Weitere bedeutende Verfahren sind das Wacker-Hoechst-Verfahren, bei dem Propen durch Sauerstoff in Gegenwart einer wässrigen Lösung von Palladium- und Kupferchlorid bei 110 bis 120 °C und 10 bis 14 Bar oxidiert wird. Von Bedeutung ist auch die Synthese aus Cumol, das aus Benzol und Propen hergestellt werden kann. Bei der Oxidation mit Sauerstoff entsteht aus Cumol zunächst Cumolhydroperoxid, das dann unter dem Einfluss von starken Säuren in Phenol und Aceton zerfällt.
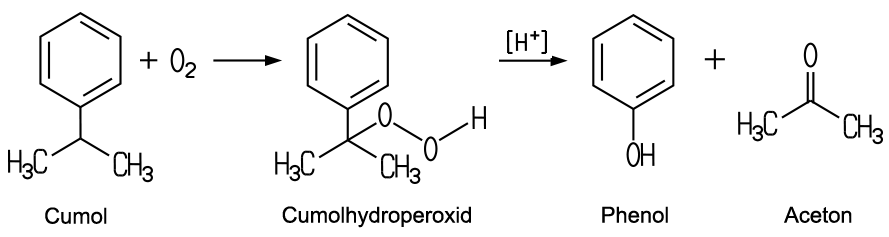

Weitere bedeutende Verfahren sind das Wacker-Hoechst-Verfahren, bei dem Propen durch Sauerstoff in Gegenwart einer wässrigen Lösung von Palladium- und Kupferchlorid bei 110 bis 120 °C und 10 bis 14 Bar oxidiert wird. Von Bedeutung ist auch die Synthese aus Cumol, das aus Benzol und Propen hergestellt werden kann. Bei der Oxidation mit Sauerstoff entsteht aus Cumol zunächst Cumolhydroperoxid, das dann unter dem Einfluss von starken Säuren in Phenol und Aceton zerfällt.

Aceton dient in der Lack- und Klebstoffindustrie als universelles Lösungs- und Extraktionsmittel für Cellulose, Vinylharze, Chlorkautschuk, Celluloid, Ethen, aber auch für etherische Öle, Chlorophyll oder Harze. Es wird als Abbeizmittel für Öl- und Lackfarben verwendet oder als Zwischenprodukt zur Herstellung weiterer organischer Chemikalien wie Bromaceton (Tränengas), Chloroform oder Diacetonalkohol. Es dient als Lösungsmittel bei der Herstellung von Schießbaumwolle oder zur Synthese des Explosivstoffs Acetonperoxid (TATP), das trotz seiner extrem unsicheren Handhabung bei terroristischen Anschlägen, beispielsweise in London im Sommer 2005, schon öfters eingesetzt wurde.
Weitere Infos
Ketone als Stoffgruppe in der organischen Chemie
Weitere Infos
Ketone als Stoffgruppe in der organischen Chemie
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen