 |
Weißes, kristallines Pulver, das sich unter Lichteinwirkung grauschwarz verfärbt. Vorkommen Mineral Chlorargyrit |
Molmasse 143,321 g/mol AGW 0,01 mg/m3 E (TRGS 900) Dichte 5,56 g/cm3 Schmelzpunkt +455 °C Siedezpunkt +1547 °C Wasserlöslichkeit 100g H2O lösen bei 20 °C 0,000188 g |
| Piktogramme GHS 05 GHS 09 Gefahr |
Gefahrenklassen
+ Kategorie Korrosiv gegenüber Metallen 1 Gew ässergefährdend akut/chron. 1 |
HP-Sätze (siehe Hinweis) H 290, 400, 410 P 273, 280.1-3, 390 Entsorgung G 4 |
| Deutscher Name | Englischer Name | |
| CAS 7783-90-6 | Silber(I)-chlorid | Silver(I) chloride |
Bemerkung
für Schulen: Es wird empfohlen, Silber(I)-chlorid nicht
anzuschaffen, da es sehr instabil ist. Man kann es durch eine
Fällung von Silber(I)-nitratlösung mit Natriumchlorid herstellen. Bei wenig Licht kann man dann das ausgefällte, schwer
lösliche Silber(I)-chlorid abfiltrieren, das für die
geplanten Experimente verwendet wird.
Eigenschaften Silber(I)-chlorid
ist ein weißes, kristallines Pulver, das sich unter
Lichteinwirkung in relativ kurzer Zeit grauschwarz verfärbt. Dabei
bildet sich Silber und Chlor. Beim Erhitzen auf 455°C entsteht eine gelbe Schmelze. Das
Salz ist nur ganz wenig wasserlöslich. In Ammoniaklösung,
Ammoniumsalzlösungen, konzentrierter Salzsäure oder in
Natriumthiosulfatlösung bilden sich lösliche Komplexe. Silberbromid und Silberiodid bilden dagegen in Ammoniaklösung keine Komplexe.
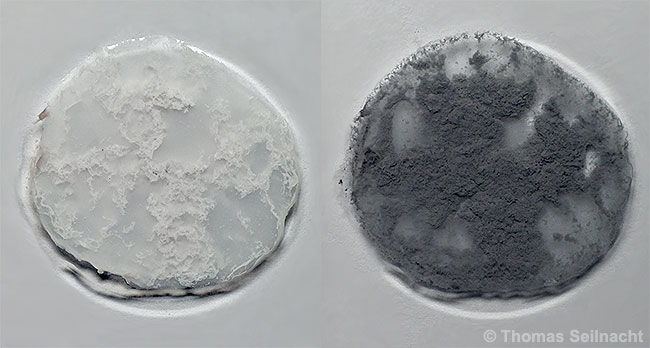 Durch Fällung hergestelltes Silberchlorid färbt sich am Licht nach kurzer Zeit dunkel. |
| Herstellung Gibt man zu einer wässrigen Silbernitrat-Lösung Kaliumchlorid oder Natriumchlorid, entsteht in einer Fällungsreaktion das schwer
lösliche, weiße Silberchlorid. Dieses kann durch Filtrieren
bei wenig Licht abgetrennt werden.
AgNO3 + KCl |
| Verwendung Die oben beschriebene Fällungsreaktion von Silbernitrat mit Chloriden zum Silberchlorid wird in der analytischen Chemie als Nachweisreaktion für Chlorid-Ionen eingesetzt. Die Reaktion wird auch verwendet, um die Silberkonzentration in Proben zu bestimmen. Lichtempfindlichen Filme oder Fotoplatten enthalten Silberchlorid oder das noch empfindlichere Silberbromid. Silberchlorid wird auch als Elektrolyt an Elektroden eingesetzt, beispielsweise beim Durchführen eines Elektrokardiogramms (EKG) zur Messung der Herzaktivität. Silbersalze in der Fotografie |