Nur für Lehrkräfte geeignet
Inhalt
Didaktische Bemerkungen Demonstration 1 „Rollende Münzen“ Demonstration 2 Polyiodidstärke-Polyiodid-Gleichgewicht Demonstration 3 Stickstoffdioxid-Distickstofftetroxid-Gleichgewicht Ausblick Literatur Zunächst wird nochmals
auf die Schülerübung „Reaktion
von Salzsäure mit Zink“ Bezug genommen. Bei diesem Versuch handelte
es sich um ein offenes System (Näheres siehe unter dem Begriff „Chemisches
Gleichgewicht“). Der Unterschied zwischen einem offenen und einem geschlossenen
System wird daran verdeutlicht. Das Prinzip, wie sich ein Gleichgewicht
einstellt, wird im Anschluss daran spielerisch aufgezeigt:
Demonstration 1 „Rollende Münzen“ Durchführung: Ein etwa 2×1 Meter großes Spielfeld wird mit vier Holzlatten umrahmt und in der Mitte durch eine Linie in zwei Felder aufgeteilt. Zwei Spieler erhalten je zehn 1-Cent-Münzen oder 5-Rappen-Stücke. Sie versuchen, die Münzen in das gegnerische Spielfeld zu rollen. Werfen oder schieben ist nicht erlaubt. Wer nach einer bestimmten Zeitspanne weniger Münzen in seinem Feld hat, gewinnt das Spiel. Beobachtungen: Sind die Spieler gleich geschickt, bleibt die Zahl der Münzen in den beiden Feldern etwa gleich. Ist ein Spieler wesentlich geschickter, dann nimmt die Zahl der Münzen auf seinem Feld relativ schnell ab. Allerdings besitzt er dann auch weniger „Nachschub“, was zu einer selbstregulierenden Korrektur führt. 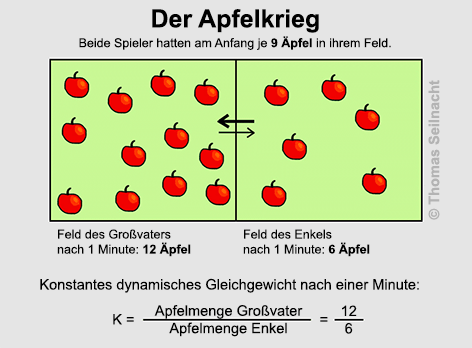 Theorie:
Das beschriebene Spiel entspricht dem Modellbeispiel
„Apfelkrieg“: Ein Großvater spielt gegen seinen Enkel im Garten.
Jeder Spielteilnehmer erhält zu Beginn 9 Äpfel. Ziel des Spiels
ist es, in das gegnerische Feld möglichst viele Äpfel zu werfen.
Nach einiger Zeit lässt sich feststellen, dass sich ein konstantes,
dynamisches Gleichgewicht einstellt. Im Feld des Großvaters befinden
sich mehr Äpfel als im Feld des Enkels.
Variationen: Es eignen sich auch Spiele in der Turnhalle, zum Beispiel mit Tennisbällen oder mit Fußbällen und einem Netz zur Spielfeldtrennung. Es kann dann ausprobiert werden, was mit dem Gleichgewicht passiert, wenn ein Fußballer gegen einen Laienfußballer oder ein Tennisspieler gegen einen Nicht-Tennisspieler antritt. Vorbereitende Arbeiten: Durch das Auflösen von 0,5 Gramm löslicher Stärke in 0,1 Liter Wasser stellt man eine 0,5%ige Stärke-Lösung her. Danach werden 0,2 Gramm Kaliumiodid in 10 Milliliter Wasser gelöst und mit 0,1 Gramm Iod versetzt. Nun füllt man auf 100 Milliliter auf und erhält eine 0,3%ige Iod-Kaliumiodid-Lösung. In einem 600ml-Becherglas werden 0,5 Liter Wasser auf 60 °C erhitzt. Schutzbrille und Schutzhandschuhe tragen! Durchführung:
1.) Zwei Reagenzgläser
werden zu einem Drittel mit der verdünnten Stärke-Lösung
gefüllt und mit jeweils gleich vielen Tropfen Iod-Kaliumiodid-Lösung
versetzt, so dass eine Blaufärbung auftritt. Die Blaufärbung
bleibt nach dem Schütteln bestehen.
2.) Ein Reagenzglas wird in das 60 °C warme Wasserbad gestellt. Danach vergleicht man die Färbung der warmen Lösung mit der Färbung der kalten Lösung. 3.) Beim Abkühlen der warmen Lösung findet ebenfalls ein Farbeffekt statt, der genau beobachtet wird. Das Abkühlen kann durch das Halten des Reagenzglases unter einen Strahl kaltes Wasser beschleunigt werden. Alternativ kann man das Reagenzglas – wie im Foto unten – auch in ein Wasserbad mit kaltem Wasser stellen. Film Beobachtungen:
Beim Erwärmen verschwindet die Blaufärbung,
die Lösung wird farblos. Beim Abkühlen kehrt die blaue Färbung
allmählich wieder zurück.
Theorie: Beim Mischen von Iod und Kaliumiodid entsteht ein Iodid-Polymer (Polyiodid), das aus einer langen Kette miteinander verbundener Iodid-Ionen besteht. Das Polyiodid ist farblos. Es reagiert mit den Hydroxy-Gruppen in den Ketten-Molekülen der Stärke zu einem Polyiodidstärke-Komplex. Die Elektronen im Iodid-Polymer sind delokalisiert. Sie werden beim Interagieren mit den Stärke-Molekülen durch sichtbares Licht angeregt und absorbieren einen Teil des Lichts. Der Polyiodidstärke-Komplex erscheint dadurch blau oder blauviolett. Die Reaktion mit der Stärke verläuft exotherm unter Wärmeabgabe. Anhand der Färbungen kann die Lage des Gleichgewichts beurteilt werden. Nach dem Prinzip von Le Chatelier weicht das chemische Gleichgewicht bei einer Erwärmung dem ausgeübten Zwang aus. Eine Erwärmung begünstigt also die endotherme Teilreaktion, und das Gleichgewicht verschiebt sich in Richtung der Ausgangsstoffe Polyiodid und Stärke. Beim Abkühlen nimmt die exotherme Teilreaktion wieder zu und die Bildung des Polyiodidstärke-Komplexes wird wieder begünstigt: Polyiodidstärke-Komplex (blau) Demonstration 3 Stickstoffdioxid-Distickstofftetroxid-Gleichgewicht Vorbereitende Arbeiten: Der vorbereitende Versuch darf nur in einem gut ziehenden Abzug durchgeführt werden! Schutzbrille und Schutzhandschuhe tragen! Stickstoffdioxid ist toxisch, er darf auf gar keinen Fall eingeatmet werden! Die Steckbriefe zum Stickstoffdioxid und zum Blei(II)-nitrat müssen gelesen werden. Die Demonstration ist aufgrund der Toxizität der Stoffe für Schulen ungeeignet. Es wird der Einsatz eines Films empfohlen. Daher wird keine Gefährdungsbeurteilung angeboten. Ein Reagenzglas 20×180 mm wird quer in ein Stativ gespannt und mit 4 Gramm Blei(II)-nitrat gefüllt. Danach erhitzt man das Blei(II)-nitrat mit der nicht leuchtenden Brennerflamme kräftig, bis es sich zersetzt und rotbraunes Stickstoffdioxid entsteht. Man füllt zwei starkwandige Reagenzgläser 20×120 mm mit dem Gas, so dass beide Reagenzgläser mit der gleichen Färbung erscheinen. Danach verschließt man die Reagenzgläser so fest wie möglich mit einem Stopfen. Man kann auch mit Stickstoffdioxid gefüllte Glas-Ampullen herstellen, die zugeschmolzen werden. Solche Ampullen lassen sich dann immer wieder und relativ sicher handhaben. Durchführung: 1.) Zur Herstellung einer Kältemischung füllt man ein hohes 150ml-Becherglas mit 150 Milliliter zerstoßenem Eis und fügt 50 Gramm Calciumchlorid hinzu. Nach dem Umrühren misst man mit einem Thermometer die entstehende Temperatur. Als Alternative kann auch Trockeneis verwendet werden. 2.) Ein zweites Becherglas wird mit 30 °C warmem Wasser gefüllt. Achtung: Bei höheren Temperaturen treibt es den Stopfen aus dem Reagenzglas, daher fest verschließen und nicht höher erwärmen! 3.) Die beiden Reagenzgläser oder Ampullen mit dem Stickstoffdioxid werden demonstrativ gezeigt und die Färbungen verglichen. Dann stellt man das eine Reagenzglas in die Kältemischung, das andere in das warme Wasser. Nach einer Weile vergleicht man erneut die Färbungen und beobachtet wie sich die Färbungen mit der Zeit wieder angleichen. Die Reagenzgläser können auch auf einen Overheadprojektor gelegt werden. Die Abbildung zeigt die Apparatur aus einer Verfilmung, in der das Erhitzen des Blei(II)-nitrats und die Farbreaktionen der entstehenden Stickstoffoxide in Eiswasser, in Wasser bei 20 °C und in warmem Wasser dargestellt werden: Diese Demonstration ist für Schulen nicht geeignet. Film
Beobachtungen:
Beim Abkühlen wird die gelbe Farbe heller,
beim Erwärmen nimmt die Färbung wieder zu.
Theorie: Beim Erhitzen des Blei(II)-nitrats entsteht rotbraunes Stickstoffdioxid: 2 Pb(NO3)2 Unter 0 °C wandeln sich die meisten Stickstoffdioxid-Moleküle in Distickstofftetroxid-Moleküle um: 2 NO2 Nach dem Prinzip von
Le Chatelier begünstigt eine Temperaturerniedrigung die exotherme
Teilreaktion. Daher verschiebt sich das Gleichgewicht beim Abkühlen
in Richtung des farblosen Distickstofftetroxids (in der Gleichung nach
rechts). Eine Erwärmung begünstigt die endotherme Teilreaktion,
es entsteht wieder mehr Stickstoffdioxid. Das Gleichgewicht verschiebt
sich nach links. Bei 27 °C sind etwa 20 % des Distickstofftetroxid zu
Stickstoffdioxid zerfallen. Unter 0 °C kommen nur noch Spuren
vor. Bei 150 °C liegt das Gleichgewicht fast ganz auf der Seite des Stickstoffdioxids.
Darüber zerfällt Stickstoffdioxid in Stickstoffmonoxid und Sauerstoff:
2 NO2 Im Anschluss folgen Beispiel
aus der Technik, wo chemische Gleichgewichte von Bedeutung sind, zum Beispiel bei
der Ammoniaksynthese oder bei der Schwefelsäureherstellung. Die
Schüler erkennen, dass das Gleichgewicht von äußeren Bedingungen
abhängt. Der Begriff „Gleichgewicht“ spielt in der Natur bei den ökologischen
Gleichgewichten eine bedeutende Rolle. Ökosysteme sind komplexer als
chemische Systeme.
Werden chemische Gleichgewichte mit ökologischen Gleichgewichten verglichen, erkennt man viele Gemeinsamkeiten. Beide Systeme erreichen bei bestimmten äußeren Bedingungen einen stabilen Zustand, beide versuchen bei Änderungen diese Stabilität wieder herzustellen und beide regulieren sich von selbst.
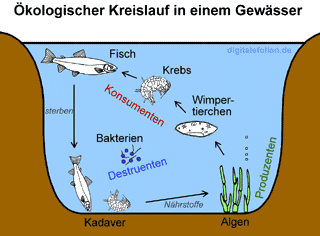
Dieses Thema führt
dann zu den ökologischen Aspekten der Chemie hin. Stoffkreisläufe
werden diskutiert und Themen wie Nachwachsende
Rohstoffe oder Nachhaltigkeit kommen zur Sprache (zur Rolle des Sauerstoffs
in nachfolgender Grafik siehe unter dem Begriff Gewässerverschmutzung).
|