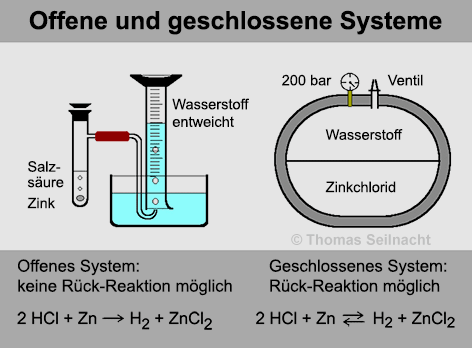
Wirft
man ein Zink-Stückchen in ein Reagenzglas, das mit verdünnter
Salzsäure gefüllt ist, entsteht
Wasserstoff, der aus dem Reagenzglas entweicht
und in einem Messzylinder aufgefangen werden kann. Das entstehende Produkt
geht dem System verloren, es handelt sich daher um ein offenes System.
Diese Reaktion wäre auch umkehrbar, wenn man die Produkte Wasserstoff
und Zinkchlorid bei hohen Temperaturen und unter hohem Druck in einen abgeschlossenen
Behälter sperren würde. Man erhält dann ein geschlossenes
System. Bei geschlossenen Systemen stellt sich nach einiger Zeit ein
chemisches Gleichgewicht ein.
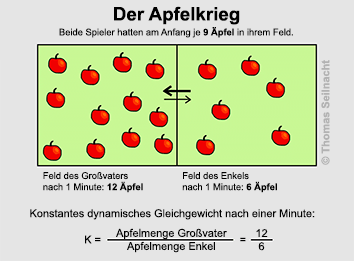
Dieses Phänomen
soll zunächst anhand des Modellbeispiels "Apfelkrieg" erläutert
werden: Ein Großvater spielt gegen seinen Enkel im Garten ein merkwürdiges
Spiel. Jeder Spielteilnehmer erhält zu Beginn 9 Äpfel. Ziel des
Spiels ist es, in das gegnerische Feld möglichst viele Äpfel
zu werfen. Nach einiger Zeit lässt sich feststellen, dass sich ein
konstantes, dynamisches Gleichgewicht einstellt. Im Feld des Großvaters
befinden sich mehr Äpfel als im Feld des Enkels.
Nun lässt sich auch
die Gleichgewichts-Reaktion zwischen Iod und Wasserstoff besser verstehen.
Ein Gemisch zwischen gasförmigem Iod und gasförmigem Wasserstoff
reagiert in einem abgeschlossenen System bei erhöhter Temperatur teilweise
zu Iodwasserstoff.
Hin-Reaktion: H2 (g) + I2 (g)
Die Reaktion erfolgt jedoch
nicht vollständig, da Iodwasserstoff bei der gleichen Temperatur teilweise
wieder zu Iod und Wasserstoff zerfällt:
Rück-Reaktion: 2 HI (g)
Es stellt sich ein chemisches
Gleichgewicht ein, bei dem alle an der chemischen Reaktion beteiligten
Stoffe in einem bestimmten Mengenverhältnis vorliegen. Dabei spielt
es keine Rolle, ob man mit den Ausgangsstoffen oder mit den Produkten startet,
stets stellt sich der gleiche Gleichgewichtszustand ein.
Der Doppelpfeil kennzeichnet
die Gleichgewichts-Reaktion. Bei der Hin-Reaktion nimmt die Konzentration
der Ausgangsstoffe ständig ab, dadurch verringert sich die Geschwindigkeit
der Hin-Reaktion. Gleichzeitig nimmt die Konzentration der Produkte zu,
somit vergrößert sich die Geschwindigkeit der Rück-Reaktion.
Ist die Reaktionsgeschwindigkeit von Hin- und Rück-Reaktion gleich,
ist das chemische Gleichgewicht eingestellt.
Massenwirkungsgesetz
Es lässt sich eine
Gleichgewichtskonstante mit einem bei gegebener Temperatur charakteristischen
Wert aufstellen. Für eine chemische Reaktion nach dem Typ:
aA + bB
gilt die temperaturabhängige
Gleichgewichtskonstante oder Massenwirkungskonstante K:
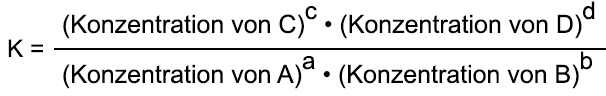
Wenn der Quotient aus
dem Produkt der Konzentrationen der Endstoffe und dem Produkt der Konzentrationen
der Ausgangsstoffe einen konstanten Wert erreicht, ist der Gleichgewichtszustand
erreicht. Dieses Gesetz bezeichneten Guldberg und Waage im Jahre 1867 als
Massenwirkungsgesetz.
Beispiel zu Berechnung

Bei der Reaktion von Iod und Wasserstoff zu Iodwasserstoff erhält man bei einer bestimmten Temperatur eine Konzentration von 3,531 mol/l Iodwasserstoff. Gleichzeitig liegen die Ausgangsstoffe in einer Konzentration 0,4789 mol/l vor. Nun werden die Konzentrationen in die Gleichung des Massenwirkungsgesetzes eingesetzt:
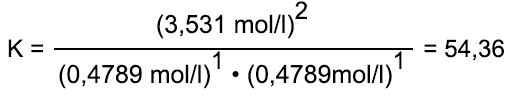
Die Konstante K = 54,36 gilt für eine bestimmte Temperatur und erhöht sich mit abnehmender Temperatur.
Beeinflussung der chemischen Gleichgewichte
Ob die Lage des Gleichgewichts mehr auf Seiten der Produkte oder mehr bei den Ausgangsstoffen liegt, hängt von mehreren Faktoren ab. Bei sehr großen Werten der Gleichgewichtskonstanten liegt das Gleichgewicht überwiegend auf der Seite der Produkte, bei sehr kleinen Werten auf der Seite der Ausgangsstoffe.
1.) Eine Veränderung der Temperatur führt zu einer Verschiebung des Gleichgewichts. Dies soll an der Gleichgewichtsreaktion von Stickstoffdioxid zu Distickstofftetroxid verdeutlicht werden:
Beispiel zu Berechnung

Bei der Reaktion von Iod und Wasserstoff zu Iodwasserstoff erhält man bei einer bestimmten Temperatur eine Konzentration von 3,531 mol/l Iodwasserstoff. Gleichzeitig liegen die Ausgangsstoffe in einer Konzentration 0,4789 mol/l vor. Nun werden die Konzentrationen in die Gleichung des Massenwirkungsgesetzes eingesetzt:
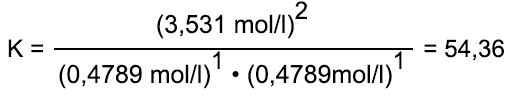
Die Konstante K = 54,36 gilt für eine bestimmte Temperatur und erhöht sich mit abnehmender Temperatur.
Beeinflussung der chemischen Gleichgewichte
Ob die Lage des Gleichgewichts mehr auf Seiten der Produkte oder mehr bei den Ausgangsstoffen liegt, hängt von mehreren Faktoren ab. Bei sehr großen Werten der Gleichgewichtskonstanten liegt das Gleichgewicht überwiegend auf der Seite der Produkte, bei sehr kleinen Werten auf der Seite der Ausgangsstoffe.
1.) Eine Veränderung der Temperatur führt zu einer Verschiebung des Gleichgewichts. Dies soll an der Gleichgewichtsreaktion von Stickstoffdioxid zu Distickstofftetroxid verdeutlicht werden:
2 NO2 (g)
Eine Temperaturerhöhung
begünstigt die endotherme Teil-Reaktion, das Gleichgewicht verschiebt
sich nach links. Die Teil-Reaktion nach rechts wäre die exotherme Reaktion,
die Teil-Reaktion nach links die endotherme. Daher bildet sich bei einer
Temperaturerhöhung mehr braunes Stickstoffdioxid (NO2).
Eine Temperatursenkung begünstigt die exotherme Teil-Reaktion. Bei einer Temperatursenkung nimmt die braune Farbe wieder ab und es bildet sich mehr farbloses Distickstofftetroxid, das Gleichgewicht verschiebt sich nach rechts.
2.) Sind Gase beteiligt, verschiebt auch eine Veränderung des Drucks das chemische Gleichgewicht. Erhöht sich in einem geschlossenen Stoffsystem der Druck, verschiebt sich das Gleichgewicht in die Richtung, in welcher die Stoffe weniger Volumen einnehmen. Beispiel: Bei der Ammoniaksynthese reagieren ein Volumen-Anteil Stickstoff mit drei Volumen-Anteilen Wasserstoff zu zwei Volumen-Anteilen Ammoniak-Gas:
Eine Temperatursenkung begünstigt die exotherme Teil-Reaktion. Bei einer Temperatursenkung nimmt die braune Farbe wieder ab und es bildet sich mehr farbloses Distickstofftetroxid, das Gleichgewicht verschiebt sich nach rechts.
2.) Sind Gase beteiligt, verschiebt auch eine Veränderung des Drucks das chemische Gleichgewicht. Erhöht sich in einem geschlossenen Stoffsystem der Druck, verschiebt sich das Gleichgewicht in die Richtung, in welcher die Stoffe weniger Volumen einnehmen. Beispiel: Bei der Ammoniaksynthese reagieren ein Volumen-Anteil Stickstoff mit drei Volumen-Anteilen Wasserstoff zu zwei Volumen-Anteilen Ammoniak-Gas:
N2 (g) + 3 H2 (g)
Folglich verschiebt sich
das Gleichgewicht bei einer Druckerhöhung nach rechts, da dort weniger
Gas-Volumen zu erwarten ist.
Prinzip von Le Chatelier
Im
Jahre 1884 versuchte der französische Chemiker Henry Louis Le Châtelier
(1850–1936) ein Gesetz zu formulieren, das allgemein beschreibt, wie sich
ein Gleichgewicht verschiebt, wenn sich die äußeren Bedingungen
wie Temperatur und Druck ändern. Das Gesetz ist als Prinzip
von Le Chatelier oder als Prinzip der Flucht vor dem Zwang bekannt geworden:
Wird auf ein im Gleichgewicht befindlichen System durch Änderung der äußeren Bedingungen ein Zwang ausgeübt, so verschiebt sich das Gleichgewicht derart, dass es dem Zwang ausweicht. Es stellt sich ein neues Gleichgewicht mit vermindertem Zwang ein.
Obwohl das Prinzip keine quantitativen Aussagen machen kann, macht es wesentliche Aussagen bei der Herstellung chemischer Produkte in Labor und Technik.
Neben der Temperatur- und Druckänderung bewirkt auch eine Änderung der Konzentration der beteiligten Stoffe eine Verschiebung des Gleichgewichts. Nach dem Quotienten
Wird auf ein im Gleichgewicht befindlichen System durch Änderung der äußeren Bedingungen ein Zwang ausgeübt, so verschiebt sich das Gleichgewicht derart, dass es dem Zwang ausweicht. Es stellt sich ein neues Gleichgewicht mit vermindertem Zwang ein.
Obwohl das Prinzip keine quantitativen Aussagen machen kann, macht es wesentliche Aussagen bei der Herstellung chemischer Produkte in Labor und Technik.
Neben der Temperatur- und Druckänderung bewirkt auch eine Änderung der Konzentration der beteiligten Stoffe eine Verschiebung des Gleichgewichts. Nach dem Quotienten
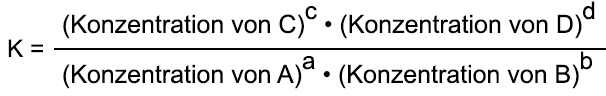
bewirken eine Zugabe
von
A oder B und ein Entzug von C oder D eine Verschiebung des
Gleichgewichts
in Richtung der Produkte C und D. Dadurch wird die Einhaltung des
gleichen Werts
der Gleichgewichtskonstante garantiert. Entweicht ein Produkt laufend
wie in einem offenen System, verläuft die Reaktion fast
vollständig
Richtung Produktseite.
Zusammenfassung
Will man bei einer Synthese eine möglichst große Ausbeute erreichen, dann
- ändert man die Temperatur und den Druck so, dass das Gleichgewichts-System dem Zwang in Richtung der Produkte ausweicht,
- erhöht man die Konzentration eines Ausgangsstoffes,
- nimmt man ein Produkt ständig weg oder fügt zusätzlich noch einen Katalysator hinzu. Dies verändert allerdings die Gleichgewichts-Konstante nicht, sondern beschleunigt das Einstellen des Gleichgewichts.
Demonstrationen zu den chemischen Gleichgewichten
Ammoniaksynthese
Buch individuell erstellen: Basis-Text Chemisches Gleichgewicht


> Inhaltsverzeichnis