Ein Kubikzentimeter der Substanz
wird im Reagenzglas mit 2 ml frisch zubereiteter 24%iger Salpetersäure versetzt und erhitzt. Zum sicheren Nachweis verwendet man konzentrierte
Salpetersäure. Beim Vorhandensein von aromatischen Eiweißen
verfärbt sich die Lösung gelblich.
Theorie
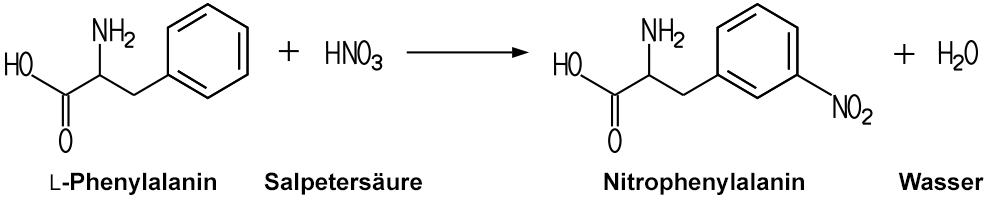
Aromatische Eiweiß-Moleküle
wie L-Phenylalanin oder L-Tyrosin besitzen einen Benzolring.
Die Eiweiße kommen vor allem in der Milch und im Käse vor. Bei
der Zugabe von Salpetersäure findet eine Nitrierung am Benzolring
statt, wobei eine gelbe Nitroverbindung entsteht. Dabei wird ein Wasserstoff-Atom
durch die NO2-Gruppe (aus der Salpetersäure) substituiert.
Aus diesem Grund verfärbt sich die Haut beim Kontakt mit konzentrierter
Salpetersäure gelblich, da die Haut-Epidermiszellen aromatische Eiweiße
enthalten.
Sicherheit 


Salpetersäure
ist ätzend und wirkt stark oxidierend. Es müssen Schutzbrille
und Schutzhandschuhe getragen werden. Das Arbeiten erfolgt im Abzug.
Führen Schüler diese Probe durch, darf nur
mit verdünnter Salpetersäure gearbeitet werden.
GBU Deutschland Experimente mit Salpetersäure docx pdf
SB Schweiz Experimente mit Salpetersäure docx pdf
GBU Deutschland Experimente mit Salpetersäure docx pdf
SB Schweiz Experimente mit Salpetersäure docx pdf