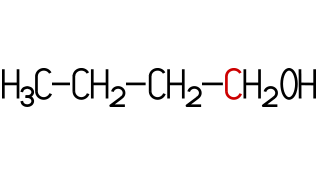|
 Klare, farblose Flüssigkeit Vorkommen (iso-Butanol) Nebenprodukt bei der Gärung, im Tee und bei Fäulnisprozessen |
Molmasse 74,121 g/mol AGW 100 ml/m3 (TRGS 900) Dichte 0,8148 g/cm3 Schmelzpunkt −88,60 °C Siedepunkt +117,6 °C Wasserlöslichkeit Konz. bei 25 °C 80 g/l Brechungsindex (20°C) 1,3988 Explosionsgrz. 1,4 bis 11,2 Vol.-% (Luft) Flammpunkt +37 °C Zündpunkt +343 °C |
| Piktogramme GHS 02 GHS 05 GHS 07 Gefahr |
Gefahrenklassen
+ Kategorie Entzündbare Flüssigkeiten 3 Akute Toxizität oral 4 Ätz-/Reizwirkung auf die Haut 2 Schwere Augenschäd./-reizung 1 Spez. Zielorgan-Tox. e. Atemwege 3 Spez. Zielorgan-Tox. e. ZNS 3 |
HP-Sätze (siehe auch Hinweis) H 226, 302, 315, 318, 335, 336 P 210, 261, 280.1-3, 301+312, 305+351+338, 310 Entsorgung G 1 |
| Etikett drucken | Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
| CAS 71-36-3 | Butylalkohol n-Butanol Butan-1-ol 1-Butanol |
Butyl alcohol n-Butanol Butan-1-ol 1-Butanol |
Bemerkung für Schulen: Butylalkohol ist
eine entzündbare Flüssigkeit. Der Stoff kann schwere
Augenschädigungen oder Hautreizungen verursachen. Das Arbeiten mit
einer Schutzbrille und mit Schutzhandschuhen ist vorgeschrieben.
Wirkung auf den menschlichen Körper n-Butanol und iso-Butanol
werden gut über die Lunge und über die Haut aufgenommen. Die
Dämpfe reizen Augen und Schleimhäute, bei anhaltendem Kontakt
wirken sie narkotisierend. Da die Geruchsschwelle bei 0,1 ppm liegt, kann
der Stoff leicht wahrgenommen werden. Bei lang anhaltendem Kontakt tritt
jedoch ein Gewöhnungseffekt ein. Bei oraler Aufnahme werden zunächst
die Schleimhäute gereizt, dann treten Rauschzustände mit narkotisierender
Wirkung auf. Als Symptome folgen starke Kopfschmerzen, bei hohen Dosen
können auch Leber und Nieren geschädigt werden. Gelangen die
Dämpfe oder geringe Mengen der Flüssigkeit in die Lunge, besteht
Aspirationsgefahr und die Gefahr dauerhafter Lungenschäden. Die anderen beiden Butanol-Isomere
sind nicht ganz so gefährlich. |
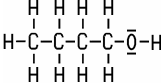
| Eigenschaften Der einwertige, primäre
Alkohol Butylalkohol ist eine klare, farblose Flüssigkeit. Er
ist nicht mehr ganz so gut in Wasser löslich wie Propylalkohol oder die anderen, kurzkettigen Alkohole. Er lässt sich aber mit organischen
Lösungsmitteln wie Ethylalkohol oder Diethylether vollständig
vermischen. Der Schmelz- und Siedepunkt ist höher als beim Propylalkohol.
Wie bei den Alkanen steigen bei den Alkoholen
mit zunehmender Kettenlänge aufgrund der steigenden Van-der-Waals-Kräfte
die Siedetemperaturen:
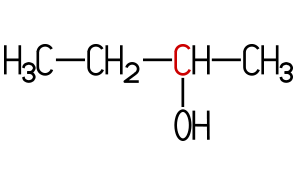
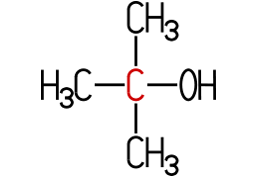
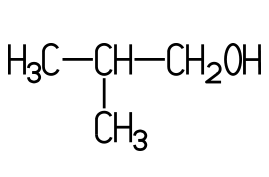
Es existieren vier Isomere.
Diese unterscheiden sich durch ihre chemisch-physikalischen Eigenschaften.
Der tertiäre Butylalkohol liegt bei Zimmertemperatur im festen Aggregatzustand
vor, er ist mit Wasser vollständig mischbar.
Alle Butanole lassen sich verestern, dabei erhält man fruchtartige
Geruchsstoffe, die als Komponenten für Parfümierungen geeignet
sind. Durch eine Abspaltung von Wasserstoff erhält man in einer Dehydrierung
aus 1-Butanol den Aldehyd Butanal.
Mit iso-Butanol entsteht 2-Methylpropanal. Zwei Moleküle 1-Butanol
lassen sich durch die Meerwein-Reaktion in Dibutylether überführen
(vgl. Ethylalkohol).
Der tertiäre Butylalkohol ist nicht oxidierbar. Mit Bromwasserstoff reagiert er aber in einer Nukleophilen Substitution (Typ SN1) zu tertiärem Butylbromid und Wasser: (CH3)3C–OH + HBr tert-Butanol + Bromwasserstoff Das Sauerstoff-Atom des Alkohol-Moleküls wird zunächst protoniert, was zu einer Abspaltung von Wasser führt. Es entsteht eine tertiäres Carbokat-Ion, das durch das nukleophile Bromid-Ion angegriffen wird und dann mit diesem reagiert. Die Reaktion findet in stark saurer Umgebung statt, daher reagiert tert-Butylbromid unter diesen Bedingungen nicht mit dem entstehenden Wasser. tert-Butylchlorid reagiert mit Wasser: Nukleophile Substitution vom Typ SN1 Wenn man reines tert-Butylchlorid vorliegen hat, dann ist eine Reaktion mit Wasser möglich. Nach dem Schütteln mit Wasser ist eine milchige Trübung zu sehen, danach trennt sich das leichtere Butylchlorid wieder ab und schwimmt auf dem Wasser. Nach leichtem und längerem Erwärmen (Butylchlorid ist leicht entzündbar!) trennen sich die Schichten nicht mehr, die Flüssigkeit wird klar und reagiert schwach sauer. (CH3)3C–Cl + H2O tert-Butylchlorid + Wasser Der Reaktionsmechanismus kann so erklärt werden: Im ersten, langsamen Schritt spaltet sich aus dem tert-Butylchlorid ein Chlorid-Ion ab, es entsteht ein positiv geladenes Carbokat-Ion. Das Wasser wirkt als polares Lösungsmittel, das die entstehenden Ionen stabilisiert: 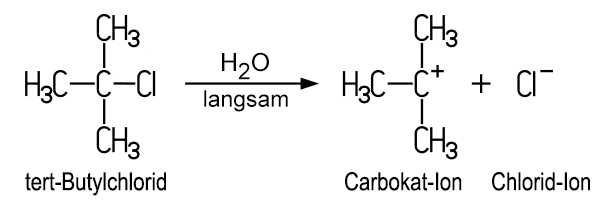
Erst im zweiten Schritt erfolgt der nukleophile Angriff des Wasser-Moleküls: Ein freies Elektronenpaar am Sauerstoff-Atom im Wasser-Molekül greift das positiv geladene C-Atom des Carbokat-Ions an, wobei das Wasser-Molekül gebunden wird. Dabei entsteht ein positiv geladenes Oxonium-Ion. Dieser Schritt verläuft schnell. Der Angriff des Nukleophils erfolgt erst in diesem zweiten Schritt. Deshalb handelt es sich um eine Nukleophile Substitution nach dem Typ SN1: 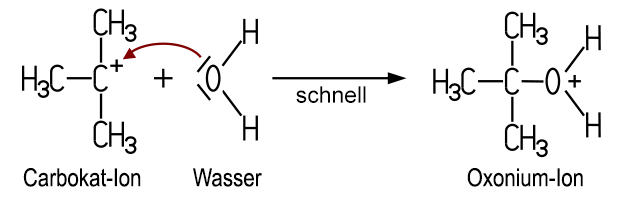
Im dritten Schritt wirkt ein weiteres Wassermolekül als Base und nimmt ein Proton vom Oxonium-Ion auf. Es entsteht das tertiäre Alkohol-Molekül, gleichzeitig bildet sich ein Hydronium-Ion. Auch dieser Schritt ist schnell: 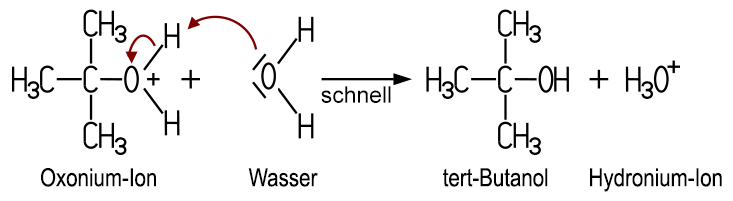
Folie: Reaktionsmechanismus |
| Herstellung Bei der alkoholischen
Gärung fallen mehrere Nebenprodukte an. Das dabei erhältliche
Stoffgemisch wird auch als Fuselöl bezeichnet. In diesem Fuselöl
finden sich Spuren von n-Butanol und iso-Butanol.Die technische Gewinnung
erfolgt heute bei der Oxosynthese aus Propylen durch eine katalytische Anlagerung von Kohlenstoffmonooxid und Wasserstoff mit Hilfe eines Cobalt-Katalysators.
Das zunächst entstehende Butanal reagiert bei 180 °C erneut mit
dem Wasserstoff, und man erhält im zweiten Schritt 1-Butanol (analoge
Reaktionsgleichung siehe Herstellung von 1-Propanol).
Von besonderer Bedeutung ist die Herstellung durch die biotechnologische Fermentation von Zucker und Stärke. Das Bakterium Clostridium acetobutylicum kann Zucker zu Aceton, n-Butanol oder iso-Butanol vergären. Aber auch andere Mikroorganismen sind in der Lage, Biobutanol zu synthetisieren. Insofern könnte dem Butanol eine Zukunft als Biotreibstoff bevorstehen. 2-Butanol wird nicht
aus Butanal hergestellt, sondern man benötigt hierzu 2-Butanon als
Ausgangsstoff, einem Keton, das aus Buten synthetisiert wird (vgl. Aceton).
Zur Herstellung des tetiären Butanols benötigt man dagegen Isobuten
als Ausgangsstoff. |
| Verwendung n-Butanol ist
ein verbreitetes Lösungsmittel in der Farb- und Lackindustrie. Ein
Gemisch von n-Butanol mit Butylacetat besitzt ein hervorragendes
Lösevermögen für Nitrocellulose-Lacke. Sämtliche Butanole
dienen als Ausgangsstoff zur Herstellung von Estern und damit für
Duftkomponenten der Parfüms. Ein Gemisch aus n-Butanol und iso-Butanol eignet sich als Biokraftstoff. Der tertiäre Butanol
wird in Treibstoffen als Antiklopfmittel eingesetzt. |