Teflonverschluss |
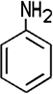 Farblose bis gelbe, ölige Flüssigkeit Vorkommen Steinkohle |
Molmasse 93,127 g/mol AGW 2 ml/m3 (TRGS 900) Dichte 1,0217 g/cm3 Schmelzpunkt −6,0 °C Siedepunkt +184,1 °C Wasserlöslichkeit Konz. bei 20 °C 36 g/l Brechungsindex (20°C) 1,5863 Explosionsgrz. 1,2 bis 11 Vol.-% (Luft) Flammpunkt +76 °C Zündpunkt +630 °C |
| Piktogramme GHS 05 GHS 06 GHS 08 GHS 09 Gefahr |
Gefahrenklassen
+ Kategorie Akute Toxizität oral 3 Akute Toxizität dermal 3 Akute Toxizität inhalativ 3 Schwere Augenschäd./-reizung 1 Sensibilisierung der Haut 1 Keimzellenmutagenität 2 Karzinogenität 2 Spez. Zielorgan-Toxizität w. Blut 1 Gewässergefährdend akut 1 |
HP-Sätze (siehe auch Hinweis) H 301, 311, 317, 318, 331, 341, 351, 372 (Blut), 400 P 260, 273, 280.1–4,7, 361, 301+310, 305+351+338, 308+313, 403+233 Entsorgung G 1 |
| Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
|
| CAS 62-53-3 | Anilin Benzolamin Aminobenzol |
Aniline Benzenamine Phenylamine |
Bemerkung
für Schulen: Aufgrund des hohen toxischen
Potenzials wird empfohlen, Anilin
nicht im Schullabor aufzubewahren. Anilin ist
blutschädigend und steht im Verdacht, krebserzeugend zu
wirken.
Wirkung auf den menschlichen Körper Anilin ist ein starkes
Blutgift. Es oxidiert den roten Blutfarbstoff Hämoglobin zu Methämoglobin
und verhindert damit den Sauerstofftransport im Blut. Das Gift kann durch
Schlucken, Einatmen und durch die Haut aufgenommen werden. Bei leichten
Vergiftungen kommt es zur Blaufärbung der Haut und der Fingernägel
und zu Schwindelanfällen und Erregungszuständen. Bei höherer
Konzentration treten Kopfschmerzen, Schwindel, Bewusstseinsstörungen
und Atemnot auf. Letzteres kann den Tod verursachen. 25 Milliliter der Flüssigkeit
gelten als tödliche Dosis. Langfristige Vergiftungserscheinungen zeigen
sich in Schwächegefühl, Appetitlosigkeit und Blasenkrebs. Beim
Verdacht auf eine Anilinvergiftung sollte man den Betroffenen an die frische
Luft bringen, betroffene Hautpartien gut abwaschen, einen Arzt hinzuziehen
und eine künstliche Beatmung durchführen. Anilin steht auch im
Verdacht, dass es Krebs auslösen oder genetische Defekte verursachen
kann.
Eigenschaften und Geschichte Reines
Anilin
ist eine farblose, ölige, aromatisch riechende Flüssigkeit,
die sich an der Luft oder im Licht infolge einer Oxidation gelb
verfärbt. Anilin brennt mit stark rußender Flamme. Es ist in
Wasser mäßig,
in den meisten organischen Lösungsmitteln wie Ethylalkohol oder
Diethylether
gut löslich. Die erstmalige Synthese aus natürlichem Indigo gelang 1826 dem
deutschen Apotheker Otto Paul Unverdorben (1806–1873). Er führte
eine trockene Destillation von Indigo zusammen mit Kalk durch. Dabei
zersetzte sich das Indigo. Das Produkt nannte Unverdorben zunächst
„Crystallin“. Der deutsche Chemiker Carl Fritzsche (1808–1871)
destillierte um 1840 Indigo mit Kalilauge und erhielt eine ölige
Flüssigkeit, die er nach dem portugiesischen Begriff anil für Indigo benannte. Der Stoff
wurde in der Folgezeit ein Wegbereiter für die moderne chemische
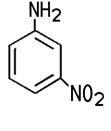
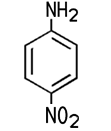
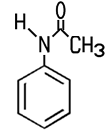
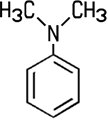
Industrie. Der Name der Firma BASF in Ludwigshafen lautet noch heute Badische Anilin- und Sodafabrik. Erst mit starken Mineralsäuren bildet das schwer wasserlösliche Anilin Salze, die in wässriger Lösung sauer reagieren. Mit Salzsäure entsteht Anilinhydrochlorid, das im Labor zum Nachweis von Lignin dient. Lässt man dieses Salz unter Wärme mit Anilin reagieren, entsteht Diphenylamin. Bei der Reaktion von Anilin mit Essigsäureanhydrid erhält man weißes, kristallines Acetanilid, das zwar fiebersenkend wirkt, aber aufgrund seiner Toxizität heute nicht mehr als Medikament eingesetzt wird. Das besser verträgliche Schmerzmittel Paracetamol ist ein Derivat des Acetanilids. Die Herstellung von Azopigmenten aus Anilin erfolgt in zwei Schritten, der Diazotierung und der nachfolgenden Azokupplung. Darüber hinaus sind zahlreiche andere Reaktionen möglich, die für die chemische Industrie von Bedeutung sind.  3-Nitroanilin, 4-Nitroanilin, Acetanilid und N,N-Dimethylanilin Die Nitroaniline können nicht direkt aus Anilin gewonnen werden. 4-Nitroanilin wird zum Beispiel durch eine Nitrierung und Hydrolyse von Acetanilid gewonnen. Die Nitroaniline sind toxisch, sie bilden orangegelbe Blättchen oder Nadeln. Sie werden unter anderem zur Herstellung von Azopigmenten benötigt. Die gelborange Flüssigkeit N,N-Dimethylanilin kann aus Anilin und Methanol in einer sauren Katalyse gewonnen werden. Es ist ein wichtiges Zwischenprodukt für die Herstellung des Farbstoffes Methylorange.
|
| Herstellung Industriell kann
man Anilin seit 1911 nach dem Laux-Verfahren durch eine Reduktion von Nitrobenzol C6H5NO2 in Gegenwart von Eisen,
Wasser und Salzsäure gewinnen. Das Wasser liefert die Wasserstoff-Atome, die das Nitrobenzol reduzieren. Das Eisen oxidiert gleichzeitig zu Eisen(II,III)-oxid, das als schwarzes Eisenoxidpigment verwendet wird. Eine Salzsäurezugabe in geringen Portionen ermöglicht die Reaktion:
4 (C6H5NO2) + 9 Fe + 4 H2O Nach der Reaktion wird Calciumoxid zur Neutralisation zugegeben. Das Anilin
wird zusammen mit dem Wasser destilliert. Im Labor führt man die Reduktion
üblicherweise mit Zinn und Salzsäure
durch. Heute existieren neuere Methoden zur Gewinnung von
Anilin: Statt Eisen werden andere Metalle wie Kupfer
oder Palladium eingesetzt. Verbreitet ist die direkte Reduktion des
Nitrobenzols durch Hydrierung mit Wasserstoff an einem Kupfer-Katalysator: C6H5NO2 + 3 H2 |
| Verwendung Anilin
ist ein bedeutendes Zwischenprodukt in der organischen Chemie. Es wird
zur Herstellung von Anilinfarbstoffen wie Anilinschwarz, von
Azopigmenten wie Brillantgelb oder von Fuchsin
verwendet. Anilin ist auch ein Rohstoff zur Synthese von Sulfanilsäure, Diphenylamin oder Hydrochinon und es wird bei der Herstellung von Synthese-Kautschuk benötigt. Früher war Anilin ein Ausgangsstoff zur Synthese von schmerzstillenden und fiebersenkenden Medikamenten wie Phenacetin, das heute aber nicht mehr eingesetzt wird. |