|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Eine Lösung
ist ein homogenes System aus einem Lösungsmittel und einem darin gelösten,
festen, flüssigen oder gasförmigen Stoff. Es können auch
mehrere Stoffe im Lösungsmittel gelöst sein. In echten Lösungen
(wie in der Kaliumpermanganat-Lösung auf dem Foto) lassen sich die
gelösten Stoffe nicht durch Filtrieren
oder durch Zentrifugieren vom Lösungsmittel
trennen. Klare (und auch farbige) Lösungen
sind homogen vermischt, sie haben eigene chemisch-physikalische Eigenschaften.
Der Siedepunkt einer Lösung ist höher als der des reinen Lösungsmittels.
in der kolloidalen Seifenlösung rechts wird das Licht stark gestreut. Kolloidale
Lösungen stellen Stoffgemische dar, bei denen die gelösten
Teilchen so groß sind, dass sie Lichtstrahlen brechen. Die Größe
der Kolloidteilchen liegt zwischen einem Nanometer und einem Mikrometer.
Sendet man durch eine kolloidale Lösung einen gebündelten Lichtstrahl,
wird das Licht gestreut. Das Phänomen ist unter dem Namen Tyndall-Effekt
bekannt. In einer Seifenlösung bilden die Seifen-Moleküle Micellen,
die groß genug sind, um das Licht zu streuen. Kolloide Partikel besitzen
in der Nanotechnologie zunehmend eine Bedeutung.
Sind die Teilchen größer als ein Mikrometer, spricht man von einer Suspension oder einer Emulsion. Der Übergang ist oft fließend. Eine Suspension liegt vor, wenn unlösliche, feste Stoffe in einer Flüssigkeit fein verteilt schwimmen. Ein Beispiel dafür wäre das Verrühren von Mehl mit Wasser bei der Teigherstellung. Bei einer Emulsion vermischen sich zwei nicht lösliche Flüssigkeiten, wenn die Flüssigkeits-Tröpfchen fein verteilt werden. Bei der Herstellung von Mayonnaise erhält man eine Emulsion von Salatöl und Eigelb. Hierbei dient das Lecithin aus dem Eigelb als Emulgator. Massenanteil der Lösungen Bei einer 12%igen Kochsalzlösung sind in 100 Gramm der Lösung 12 % Kochsalz oder 12 Gramm Kochsalz enthalten. Die notwendigen Mengen können berechnet werden: Wenn in 100 Gramm Lösung 12 % Massenanteile Kochsalz enthalten sind, muss man 12 Gramm Kochsalz mit 88 Gramm oder 0,088 Liter Wasser mischen. Bei wasserhaltigen Salzen wie beim blauen Kupfer(II)-sulfat Pentahydrat CuSO4 • 5 H2O ist zu berücksichtigen, dass der Wasseranteil die Berechnung den Anteil an gelöstem Kupfer(II)-sulfat verfälscht. Entweder muss der Anteil umgerechnet werden oder man benutzt nur wasserfreie Stoffe wie weißes Kupfer(II)-sulfat CuSO4. 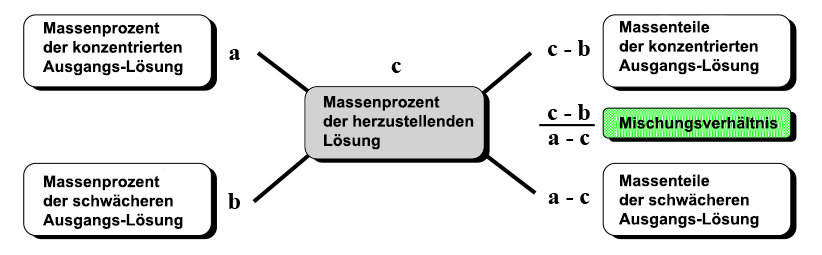
Konzentrierte und verdünnte
Säuren oder Laugen werden oft in Massenprozenten angegeben. Aus konzentrierten
Lösungen lassen sich die verdünnten Lösungen unter Zuhilfenahme
des Mischungskreuzes verdünnen. Beispiel: Aus 65%-iger Salpetersäure
soll durch Verdünnen 12%-ige Salpetersäure hergestellt werden. Verdünnt man mit
destilliertem Wasser (0 %) stellt sich das Ergebnis aus dem Mischungskreuz
so dar:
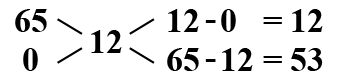
Es sind nach diesem
Beispiel also
12 Gramm 65%-ige Salpetersäure mit 53 Gramm destilliertem Wasser zu
verdünnen.
In der Literatur wird die Konzentration von Säuren oft nur als
„verdünnte“ oder „konzentrierte“ Säure angegeben. Diese Tabelle kann benutzt
werden, um ohne Berechnung schnell ungefähr 100 ml der gewünschten Lösung herzustellen:
Volumenanteil von Lösungen
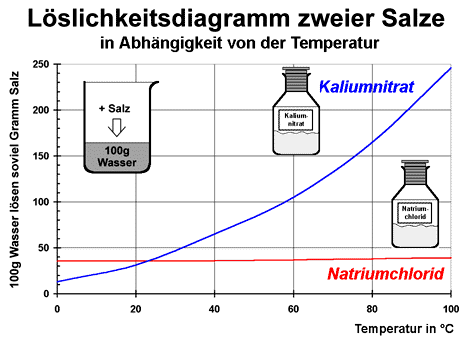
Die Volumenprozent-Angabe wird bei Salzlösungen praktisch nicht verwendet. Dagegen findet man sie häufig bei Mischungen organischer Flüssigkeiten, wie bei Alkohol-Wasser-Gemischen. So enthalten 100 Milliliter Brennspiritus mit 96 Volumenprozent Anteil genau 96 Milliliter Ethanol. Zur Herstellung einer alkoholischen Lösung mit beispielsweise 40 Volumenprozent gibt man in einen leeren Messkolben (100 ml) zunächst 40 Milliliter Ethanol und füllt dann bis zur 100ml-Markierung auf. Dabei ist zu beachten, dass Ethanol eine geringere Dichte als Wasser besitzt, außerdem tritt bei der Mischung das Phänomen der Volumenkontraktion auf: 50 Milliliter Wasser und 50 Milliliter Ethanol ergeben nicht 100 Milliliter Lösung, sondern weniger. Insofern ist die Volumenprozent-Angabe relativ ungenau. Molare Lösungen In der Maßanalyse will man eine Lösung herstellen, die zum Beispiel in einem Liter Lösung ein Mol Natriumchlorid enthält. Dazu entnimmt man einem Lexikon die chemische Formel für Natriumchlorid NaCl und addiert die relativen Atommassen der beteiligten Atome. Dabei erhält man die Stoffmenge in Gramm, die einem Mol entspricht: u(Na) + u(Cl) = 23 g/mol + 35,5 g/mol = 58,5 g/mol (gerundet) Diese Masse wird als molare Masse bezeichnet. Sie steht auch meistens bei den Formeln jedes Stoffes in einem Lexikon oder in einer Datenbank schon mit dabei. M = m ÷ n M Molare Masse m Masse n Stoffmenge Es werden also zunächst 58,5 Gramm Natriumchlorid in einem 1-Liter-Messkolben in ungefähr 500 ml destilliertem Wasser aufgelöst. Erst danach wird mit destilliertem Wasser bis zur 1-Liter-Messmarke aufgefüllt. So erhält man exakt einen Liter einer Lösung mit der Konzentration ein Mol pro Liter. (>Rechenbeispiele). Bestimmung der Löslichkeit bei Salzen Die Sättigung bei einer Salzlösung ist erreicht, wenn der Bodenkörper des Salzes in einem Gleichgewicht mit der darüber stehenden Lösung steht. Die Löslichkeit der Salze ist fast immer temperaturabhängig. Bei den meisten Salzen erfolgt das Lösen im Wasser endotherm, dann nimmt die Löslichkeit mit steigender Temperatur zu. Dies kann man in einem Löslichkeitsdiagramm darstellen: Beim Lösen eines Salzes in Wasser wird
zuerst Energie oder
Wärme benötigt, um die Ionenbindung im Salz aufzubrechen. In
einem zweiten Schritt kommt es zur Hydratation der Ionen, dabei wird
wieder Wärme abgegeben.
Wenn in der Gesamtreaktion mehr Energie aufgewendet werden muss als frei
wird, ist die Lösungsenthalpie positiv. Beim Kaliumnitrat ist die
Lösungsenthalpie (oder Lösungswärme) mit einem Wert von
+34,89 KJ/mol relativ stark positiv. Beim Lösen findet eine
Abkühlung statt. Natriumchlorid besitzt mit +3,88 KJ/mol nur eine
schwach positive Lösungsenthalpie, daher findet beim Lösen nur
eine geringe Abkühlung statt. Nur bei einigen wenigen Salzen verläuft der Löseprozess im Wasser exotherm, so das Energie
frei wird. Bei diesen Salzen ist die Lösungsenthalpie negativ, beim
Lösen erwärmt sich die Lösung. Beispiele
dafür sind Natriumhydroxid mit einer Lösungsenthalpie von
−44,51 KJ/mol oder wasserfreies Calciumchlorid mit einer
Lösungsenthalpie von −59,8 KJ/mol.
Löslichkeitsangabe In Chemikaliendatenbanken wird die Wasserlöslichkeit für anorganische Salze wie Natriumchlorid meist als Löslichkeitsangabe angegeben: 100 Gramm Wasser lösen bei 25 °C etwa 36 Gramm Kochsalz. Wenn man dies durchführt, erhält man 136 Gramm der Natriumchlorid-Lösung. Die Löslichkeitsangabe ist nicht identisch mit der Massenprozentangabe! Massenprozentangabe Wie lässt sich das oben genannte Beispiel in Massenprozent umrechnen? 136 g Kochsalzlösung = 100 % | Umformen 36 g Kochsalz = x % x = 36 g × 100 % ÷ 136 g = 26,47 % Zur Bestimmung der Löslichkeit bei einer bestimmten Temperatur, zum Beispiel bei 80 °C, erwärmt man 50 Milliliter destilliertes Wasser in einem 100ml-Becherglas auf genau 80 °C und gibt unter ständigem Rühren solange das Salz hinzu, bis ein Bodensatz entsteht. Von der klaren Lösung gibt man 10 Gramm in ein kleines Becherglas, das man vorher leer gewogen hat *). Nach dem Abdampfen des Wassers in einem Trockenschrank wiegt man das zurückbleibende Salz und kann dann die maximale Löslichkeit bei 80 °C berechnen: Erhält man nach dem Abdampfen des Wassers aus 10 Gramm Lösung beispielsweise 2,75 Gramm Kochsalz, dann enthielt die Lösung zuvor 27,5 Massenprozent Kochsalz. Bei 80 °C sind 27,5% Massenanteile Kochsalz in einer gesättigten, wässrigen Lösung enthalten. *) Alternativ kann man auch 10 Milliliter pipettieren. Dann wiegt man die 10 Milliliter Lösung und dampft das Wasser ab. Die Berechnung erfolgt dann aus dem Verhältnis der Masse der pipettierten Lösung zur Masse des nach dem Abdampfen zurückbleibenden Salzes. Konzentrationsangabe Als dritte Möglichkeit kann man auch die Löslichkeit in der Konzentration pro Liter Lösung angeben. Dies wird oft bei organischen Flüssigkeiten und bei Gas-Lösungen bevorzugt. Die Konzentrationsangabe 300 Gramm pro Liter Lösung bei 20 °C bedeutet, dass bei 20 °C in einem Liter der gesättigten Lösung 300 Gramm des Stoffes gelöst sind. Weitere Informationen Herstellungsrezepte für wichtige Lösungen |