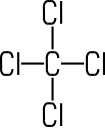
Tetrachlorkohlenstoff CCl4
 Teflonverschluss |
 Farblose Flüssigkeit |
Molmasse 153,823 g/mol AGW 0,5 ml/m3 (TRGS 900) Schmelzpunkt −22,8 °C Siedepunkt +76,7 °C Dichte 1,5940 g/cm3 Wasserlöslichkeit Konz. bei 20 °C 0,65 g/l Brechungsindex (20°C) 1,4601 |
| Piktogramm GHS 06 GHS 08 Gefahr |
Gefahrenklassen
+ Kategorie Akute Toxizität oral 3 Akute Toxizität dermal 3 Akute Toxizität inhalativ 3 Sensiblisierung der Haut 1B Karzinogenität 2 Spez. Zielorg.-Tox. w. (Leber, Nieren, ZNS) 1 Gewässergefährdend chron. 3 Die Ozonschicht schädigend 1 |
HP-Sätze (siehe Hinweis) H 301, 311, 317, 331, 351, 372 (Leber, Nieren, ZNS), 412, 420 P 261, 273, 280.1-4,6,7, 361, 301+310,309+310, 403+233 Entsorgung G 2 |
| Dt. Bezeichnung (Synonyme) |
Engl. Bezeichnung (Synonyme) |
|
| CAS 56-23-5 | Tetrachlormethan Kohlenstofftetrachlorid Tetrachlorkohlenstoff |
Tetrachloromethane Carbon tetrachloride |
Hinweise
für Schulen: Tetrachlorkohlenstoff darf an Schulen nicht
aufbewahrt und auch nicht benutzt werden. Alte Bestände sind
umgehend einem Entsorgungsunternehmen abzugeben. Bei Licht- und Wärmeeinwirkung entsteht in Anwesenheit von Feuchtigkeit das Giftgas Phosgen. Der
Stoff schädigt die Ozonschicht, daher gilt ein generelles
Verwendungsverbot. Er steht auch im Verdacht Krebs zu erzeugen. Die
akute Vergiftung äußert sich zum Beispiel in Kopfschmerzen,
Übelkeit, Schwindel oder Sehstörungen. Bewusstlosigkeit oder
Schäden am Zentralnervensystem sind möglich. Ein hohes
Gefahrenpotenzial besteht bei einer chronischen
Vergiftung: Bei der wiederkehrenden Aufnahme kleiner Mengen besteht
die Gefahr einer Leber- und Nierenschädigung, eine Leberzirrhose kann auftreten.
Eigenschaften Tetrachlorkohlenstoff
oder Tetrachlormethan ist eine schwere, farblose, leicht
süßlich riechende Flüssigkeit, die in Wasser nur ganz
wenig löslich ist. In Ethanol, Ether und Benzin ist sie gut
löslich. Auch Fette, Harze und Öle lösen sich leicht
darin auf. Tetrachlorkohlenstoff ist nicht brennbar und relativ
reaktionsträge, mit Säuren und Basen reagiert er kaum. Bei
Kontakt beispielsweise mit Alkalimetallen, Fluor, reinem Sauerstoff, mit
Oxidationsmitteln oder mit Metallpulvern besteht Explosionsgefahr.
Unter Licht- und Wärmeeinwirkung entsteht besonders in Anwesenheit
von Feuchtigkeit Phosgen. Dieses Giftgas entsteht neben weiteren toxischen Zersetzungsprodukten wie Chlor und Chlorwasserstoff auch bei einem Gebäudebrand, wenn vorhandenes Tetrachlormethan
stark erhitzt wird. Durch Freisetzung von Chlor-Radikalen in der
Atmosphäre kann der Stoff die Ozonschicht zerstören.
Früher zeigte man in Vorlesungen einen Schauversuch, bei dem wenig Kalium und Natrium in einem Reagenzglas zusammengeschmolzen und mit einem Kubikzentimer Tetrachlorkohlenstoff überschichtet wurde. Lässt man das Reagenzglas in einen Blecheimer fallen, erfolgt eine heftige Explosion. Dieser Versuch geht auf Hermann Staudinger zurück. Der Versuch darf heute nicht mehr vorgeführt werden. Die Mischung kann bereits bei Berührung des Fingerrings am Reagenzglasrand heftig explodieren. Die wiederholte Durchführung des Versuchs im offenen Raum ist aufgrund der chronischen Vergiftungsgefahr lebensgefährlich. Die Verwendung ozonschädigender Stoffe ist generell untersagt. Vier Chloralkane im Vergleich: Chlormethan ist gasförmig, Dichlormethan, Trichlormethan und Tetrachlormethan sind flüssig. |
Herstellung Tetrachlormethan ist ein Halogenkohlenwasserstoff. Er kann durch eine direkte Chlorierung von Methan erhalten werden. Dabei entstehen in einer mehrstufigen
Substitutionsreaktion bei etwa 450 °C die verschiedenenen
Chlormethane. Eine andere Möglichkeit ist die Herstellung aus
Schwefelkohlenstoff oder aus einem Propan-Propen-Gemisch. Aus Propen und Chlor entsteht Tetrachlormethan, Tetrachlorethan und Chlorwasserstoff:
H3C-CH=CH2 + 7 Cl2 |
Verwendung Tetrachlormethan
wäre ein hervorragendes Lösungsmittel für organische
Stoffe. Da es nicht brennbar ist, wurde es früher häufig
entsprechend eingesetzt, beispielsweise auch zur Extraktion. In
Feuerlöschern, den sogenannten "Tetra-Löschern", war es als
Löschmittel enthalten. Aufgrund der hohen Toxizität und vor
allem wegen der ozonschädigenden Wirkung darf der Stoff heute gar
nicht mehr verwendet werden.
|