zur Aluminiumgewinnung
Aluminium
ist aufgrund seiner chemischen Beständigkeit, seiner geringen Dichte
und seiner mechanischen Eigenschaften ein bedeutender Werkstoff. Der Hauptanteil
wird für den Verkehrssektor benötigt, aber auch die Bauindustrie,
der Maschinenbau oder die Verpackungsindustrie benötigen das begehrte
Leichtmetall. Aluminium ist nach Sauerstoff und Silicium das dritthäufigste
Element in der Erdhülle. Friedrich
Wöhler stellte im Jahr 1827 als erster durch die Reduktion von
Aluminiumchlorid mit Kalium das reine Element dar. Damals war der Preis
für Aluminium höher als für Gold. Unedle Metalle wie Aluminium
oder Magnesium mit sehr negativem Normalpotenzial lassen sich hoch rein
und wirtschaftlich rentabel aber nur in wasserfreier Umgebung aus einer
Salzschmelze gewinnen. Die
Grundlage für das Elektrolyseverfahren legten im Jahr 1886 Charles
Martin Hall (1863–1914) in den USA und Paul Héroult (1863–1914)
in Frankreich unabhängig voneinander. [Literatur
1]
Das abgebildete Stück Bauxit stammt aus Les Baux/Provence;
heute sind die Vorkommen in Les Baux nicht mehr abbauwürdig
Bauxit
ist ein häufig vorkommendes Gestein, das aus verschiedenen Aluminium-
und Eisenerzen zusammengesetzt ist. Früher gewann man den Bauxit im
südfranzösischen Les Baux, nach diesem Ort ist das Erz benannt.
Die wichtigsten Erzvorkommen befinden sich heute in Australien, Guinea,
Brasilien, Jamaika, Indien, Guyana und Indonesien. Die Aluminiumgewinnung
ist mit großem Aufwand verbunden. Bei der Erzaufbereitung
wird aus dem Bauxit Aluminiumoxid (Tonerde) angereichert. [Literatur
3] Danach erfolgt die eigentliche
Metallgewinnung mit Hilfe der Schmelzfluss-Elektrolyse.
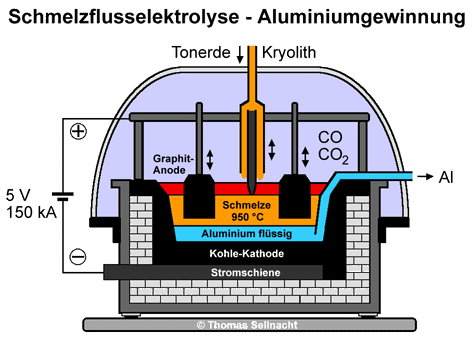
Aluminiumoxid besitzt einen sehr hohen Schmelzpunkt von etwa 2050 °C. Um diesen herabzusetzen, gibt man Kryolith Na3AlF6 und weitere Fluorverbindungen wie Aluminiumfluorid AlF3 und Calciumfluorid CaF2 im Überschuss hinzu. Der Schmelzpunkt des Gemisches liegt dann bei etwa 950 °C. Das Tonerde-Kryolith-Gemisch befindet sich in einer eisernen Wanne, die mit Kohle oder Graphit ausgekleidet ist. Die Anode besteht aus Graphitzylindern, diese tauchen in die Schmelze. Bei einer relativ geringen Spannung von 5 bis 6 Volt, aber einem sehr hohen Stromfluss von 150000 Ampere oder mehr setzt sich am Boden flüssiges Aluminium ab. [Literatur 8 und 9] Der Krustenbrecher zerbricht die gebildete Kruste und ermöglicht die Zuführung von Nachschubmaterial. [Literatur 2] Das Aluminium wird von Zeit zu Zeit abgesaugt. Das entstehende Aluminium besitzt eine maximale Reinheit von 99,9%. Dieses wird in weiteren, elektrochemischen Raffinationsprozessen auf eine Reinheit von bis zu 99,999% gebracht. [Literatur 5 und 7] An der Graphit-Anode entsteht Sauerstoff, der mit dem Kohlenstoff der Elektroden zu Kohlenstoffdioxid und Kohlenstoffmonoxid reagiert. Da sich die Elektroden zersetzen, verwendet man lange, zylindrische Stäbe, die immer weiter in die Schmelze hineingefahren werden. Nach Verbrauch werden die Stäbe einfach angesetzt, so dass das Verfahren kontinuierlich stattfinden kann.
Aluminiumoxid besitzt einen sehr hohen Schmelzpunkt von etwa 2050 °C. Um diesen herabzusetzen, gibt man Kryolith Na3AlF6 und weitere Fluorverbindungen wie Aluminiumfluorid AlF3 und Calciumfluorid CaF2 im Überschuss hinzu. Der Schmelzpunkt des Gemisches liegt dann bei etwa 950 °C. Das Tonerde-Kryolith-Gemisch befindet sich in einer eisernen Wanne, die mit Kohle oder Graphit ausgekleidet ist. Die Anode besteht aus Graphitzylindern, diese tauchen in die Schmelze. Bei einer relativ geringen Spannung von 5 bis 6 Volt, aber einem sehr hohen Stromfluss von 150000 Ampere oder mehr setzt sich am Boden flüssiges Aluminium ab. [Literatur 8 und 9] Der Krustenbrecher zerbricht die gebildete Kruste und ermöglicht die Zuführung von Nachschubmaterial. [Literatur 2] Das Aluminium wird von Zeit zu Zeit abgesaugt. Das entstehende Aluminium besitzt eine maximale Reinheit von 99,9%. Dieses wird in weiteren, elektrochemischen Raffinationsprozessen auf eine Reinheit von bis zu 99,999% gebracht. [Literatur 5 und 7] An der Graphit-Anode entsteht Sauerstoff, der mit dem Kohlenstoff der Elektroden zu Kohlenstoffdioxid und Kohlenstoffmonoxid reagiert. Da sich die Elektroden zersetzen, verwendet man lange, zylindrische Stäbe, die immer weiter in die Schmelze hineingefahren werden. Nach Verbrauch werden die Stäbe einfach angesetzt, so dass das Verfahren kontinuierlich stattfinden kann.
Die hohen elektrischen
Ströme halten das Schmelzbad flüssig. Die Gesamtreaktion ist
jedoch endotherm. Pro Mol werden 1345 Kilojoule benötigt, dies bedeutet,
dass erheblich mehr Energie zugeführt werden muss, als bei der Reaktion
frei wird. [Literatur 5]
Von der zugeführten
Energie wird die Hälfte für die Elektrolyse benötigt, die
andere Hälfte dient zur Erzeugung von Wärme, damit die Salzschmelze
heiß und flüssig bleibt. [Literatur
8]
Reaktionsgleichung
| Reduktion an der Kathode | 4 Al3+
+ 12 e− |
| Oxidation an der Anode | 3 C + 6 O2− |
| Gesamtreaktion | 2 Al2O3
+ 3 C |
Zur Herstellung von einer
Tonne Aluminium werden vier Tonnen Bauxit, bis zu 0,8 Tonnen Kohlenstoff,
4 Kilogramm Kryolith, bis zu 20 Tonnen Aluminiumfluorid und bis zu 16000
Kilowattstunden Strom verbraucht. Die geringe Menge an Flussmitteln erklärt sich
dadurch, dass diese im Kreisprozess ständig wieder eingesetzt werden
können. [Literatur 5]
In den Abgasen sind neben
dem als Treibhausgas wirksamen Kohlenstoffdioxid
und dem giftigen Kohlenstoffmonooxid
sehr aggressive Fluorverbindungen enthalten.
Damit diese nicht in die Umwelt gelangen, wird die Zelle mit einer Glocke
versehen. Durch einen Kreisprozess adsorbiert man die Fluorverbindungen
nach der Zellabsaugung mit der eingeführten Tonerde, so dass sie zurückgeführt
werden.
Ein Nachteil des Verfahrens ist der sehr hohe Energieaufwand. Die größte Aluminiumfabrik Europas befindet sich in Island, da dort durch Erdwärme Energie günstig zur Verfügung steht. [Literatur 6] Es lohnt sich sogar, den Bauxit aus Brasilien mit Schiffen in das nordische Island zu schaffen und das Aluminium in Barren wieder auszuführen. Australien, China Guinea, Jamaika oder Indien sind weitere Länder mit großen Bauxitvorkommen. Aufwändig ist auch die Beschaffung des in der Natur nur selten vorkommenden Kryoliths. Da die natürlichen Vorkommen in Grönland oder Kanada relativ bescheiden sind, stellt man das Flussmittel aus Hexafluorokieselsäure, die in natürlichen Tonerde-Vorkommen enthalten ist, her. Aufgrund des hohen Gesamt-Aufwandes lohnt sich das Recycling von Aluminium in besonderem Maße.
Ein Nachteil des Verfahrens ist der sehr hohe Energieaufwand. Die größte Aluminiumfabrik Europas befindet sich in Island, da dort durch Erdwärme Energie günstig zur Verfügung steht. [Literatur 6] Es lohnt sich sogar, den Bauxit aus Brasilien mit Schiffen in das nordische Island zu schaffen und das Aluminium in Barren wieder auszuführen. Australien, China Guinea, Jamaika oder Indien sind weitere Länder mit großen Bauxitvorkommen. Aufwändig ist auch die Beschaffung des in der Natur nur selten vorkommenden Kryoliths. Da die natürlichen Vorkommen in Grönland oder Kanada relativ bescheiden sind, stellt man das Flussmittel aus Hexafluorokieselsäure, die in natürlichen Tonerde-Vorkommen enthalten ist, her. Aufgrund des hohen Gesamt-Aufwandes lohnt sich das Recycling von Aluminium in besonderem Maße.
Literatur
1
www.aluinfo.de (abgerufen
1/2012), Gesamtverband der Aluminiumindustrie e.V.
2 Behr/Agar/Jörissen (2010): Einführung in die Technische Chemie, Heidelberg
3 Trueb, Lucien F. (2005): Die chemischen Elemente, Stuttgart
4 Roempp (1995): Chemielexikon, Stuttgart
5 Hollemann/Wiberg (2007): Lehrbuch der anorganischen Chemie, Berlin/New York
6 www.eldey.de (abgerufen 12/2011): Länderportal für Island, Aluminiumindustrie
7 Hamann/Vielstich (2005): Elektrochemie, Weinheim
8 Glöckner/Jansen u.a. (1994): Handbuch der experimentellen Chemie, Band 6 Elektrochemie, Köln
9 Binder (1999): Lexikon der chemischen Elemente, Stuttgart/Leipzig
2 Behr/Agar/Jörissen (2010): Einführung in die Technische Chemie, Heidelberg
3 Trueb, Lucien F. (2005): Die chemischen Elemente, Stuttgart
4 Roempp (1995): Chemielexikon, Stuttgart
5 Hollemann/Wiberg (2007): Lehrbuch der anorganischen Chemie, Berlin/New York
6 www.eldey.de (abgerufen 12/2011): Länderportal für Island, Aluminiumindustrie
7 Hamann/Vielstich (2005): Elektrochemie, Weinheim
8 Glöckner/Jansen u.a. (1994): Handbuch der experimentellen Chemie, Band 6 Elektrochemie, Köln
9 Binder (1999): Lexikon der chemischen Elemente, Stuttgart/Leipzig