zur Gewinnung von Chlor und Natronlauge
Chlor
ist in der chemischen Industrie ein bedeutendes Zwischenprodukt zur Herstellung
zahlreicher anderer Verbindungen (>Chemie des
Chlors). Beim Lösen von Natriumchlorid
in Wasser bilden sich durch eine Dissoziation Ionen.
Elektrolysiert man eine gesättigte, wässrige Lösung dieser
Sole mit Graphitelektroden, entsteht am Pluspol Chlor. Am Minuspol zersetzt
sich Wasser zu Wasserstoff und Hydroxid-Ionen, die mit den Natrium-Ionen
Natronlauge bilden. In modernen Verfahren
verwendet man korrosionsbeständige Anoden aus Titan, die mit Rutheniumoxid
versetzt sind und Kathoden im Form eines Stahlnetzes. [Literatur
1 und 3]
Die Zelle muss so aufgebaut sein, dass eine Chlorknallgas-Reaktion mit
Wasserstoff ausgeschlossen ist.
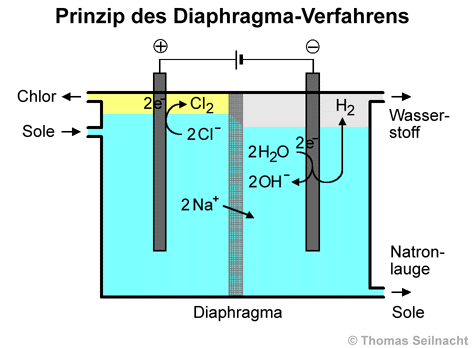
Das Diaphragma-Verfahren
Zur Chlor-Alkali-Elektrolyse
wurden drei Verfahren entwickelt, die von Bedeutung sind. Das Diaphragma-Verfahren
ist seit 1890 im Einsatz und wird vor allem in den USA verwendet. Die Vermischung
der Reaktionsprodukte in der Elektrolysezelle wird durch ein poröses
Diaphragma verhindert. Das Diaphragma besteht aus fünf Millimeter dickem Stahl-Lochblech,
auf das Asbestfasern und eine Teflon-Schicht aufgebracht sind. Dies ist
eine der letzten erlaubten Anwendungen für Asbest. [Literatur
2] Der Flüssigkeitsspiegel
ist im Anodenraum höher als im Kathodenraum. [Literatur
1] Dadurch wird verhindert,
dass die im Kathodenraum gebildeten Hydroxid-Ionen OH− in den Anodenraum wandern, während die Na+-Ionen durch
das Diaphragma hindurchwandern.
An der Anode, dem Pluspol,
werden Chlorid-Ionen zu Chlor oxidiert. An der Kathode, dem Minuspol, wird
Wasser zu Wasserstoff reduziert, wobei auch negativ geladene Hydroxid-Ionen
entstehen, die mit den positiv geladenen Natrium-Ionen Natronlauge bilden.
Die entnommene Natronlauge enthält noch einen
hohen Anteil an Sole. Durch Eindampfen der Lösung trennt sich das
Natriumchlorid ab und man erhält eine 50%ige Natronlauge, die danach
nur noch etwa 1% Natriumchlorid enthält. Das anfallende Salz wird
erneut in der Sole dem Elektrolyseprozess zugeführt.
Reaktionsgleichung
| Dissoziation in der Lösung | 2 NaCl |
| Oxidation an der Anode | 2 Cl− |
| Reduktion an der Kathode
|
2 H2O 2 H+ + 2 e− |
| Gesamtreaktion | 2 NaCl + 2 H2O |
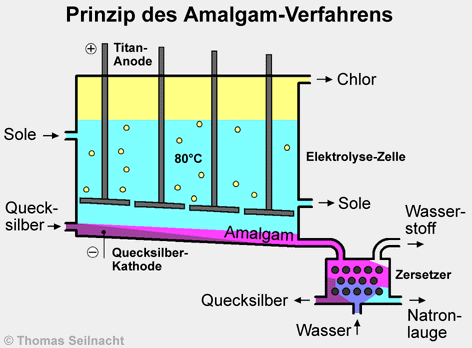
Das Amalgam-Verfahren
Das Amalgam-Verfahren
wurde um 1890 bis 1894 von dem amerikanischen Industriellen Hamilton Castner
(1858–1899) und von dem österreichischen Chemiker Karl Kellner (1851–1905)
unabhängig voneinander entwickelt. [Literatur 4]
Es wird hauptsächlich in Europa angewandt.
Die Anode besteht aus
dicken, waagerecht liegenden und mit Ruthenium beschichteten Titanplatten,
die mit Bohrungen zum Chlordurchlass versehen sind. [Literatur
5 und 6] Dort
werden Chlorid-Ionen zu elementarem Chlor
oxidiert. Als Kathode wird flüssiges Quecksilber
eingesetzt, das am Boden der Zelle als drei bis fünf Millimeter dünner Film fließt.
Die darüber fließende Sole fließt in gleicher Richtung.
Das bei der Elektrolyse entstehende Natrium bildet mit dem Quecksilber
ein Amalgam NaHg. Im Amalgam-Zersetzer rieselt das Amalgam durch
Graphitkörner, im Gegenstrom wird Wasser zugeführt. [Literatur
3] Dabei reagiert das Natrium
mit dem Wasser zu konzentrierter Natronlauge und Wasserstoff.
2 NaHg + 2 H2O
Die Elektrolyse wird
bei 80 °C und einer hohen Natriumchloridkonzentration von bis zu 270
Gramm pro Liter durchgeführt. Die Spannung beträgt 4 bis 5 Volt,
die Stromstärken können 300000 Ampere oder mehr erreichen. Der
Vorteil gegenüber dem Diaphragma-Verfahren besteht darin, dass eine
konzentrierte Natronlauge erzeugt wird, die frei von Natriumchlorid ist.
Mit dem abfließenden Amalgam werden auch Quecksilber
und Quecksilberverbindungen herausgetragen, die selbst nach dem Amalgam-Zersetzer
noch im Abwasser enthalten sind. Dies erfordert einen hohen Reinigungsaufwand,
bevor die Abwässer in die Umwelt geleitet werden.
[Literatur 5]
Reaktionsgleichung
| Oxidation an der Anode | 2 Cl− |
| Reduktion an der Kathode | 2 Na+ + 2e− |
| Reaktion im Zersetzer | 2 Na + 2 H2O |
| Gesamtreaktion | 2 NaCl + 2 H2O |
An der Kathode scheidet
sich Natrium ab und nicht Wasserstoff, wie man es eigentlich nach dem Normalpotenzial
für Natrium erwarten würde. Dies hängt damit zusammen, dass
sich das entstehende Natrium sofort mit dem Quecksilber verbindet und dass
das Metall Quecksilber die Wasserstoffentwicklung hemmt. [Literatur
1] Werden Schwermetall-Ionen
in Form von Verunreinigungen in der Sole zugeführt, entsteht an der
Kathode Wasserstoff, was zu einer Chlorknallgasreaktion führen kann.
Spuren von Vanadium, Chrom, Nickel, Eisen oder von anderen Metallen können
diese gefährliche Reaktion auslösen. Daher muss die Sole sorgfältig
gereinigt werden. [Literatur 3]
Das Membran-Verfahren
Um die Nachteile des
Diaphragma-Verfahrens und des Amalgam-Verfahrens zu umgehen, wurde in den
1990er-Jahren das Membran-Verfahren entwickelt. Die Chlorfabrik in der
BASF Ludwigshafen, die nach diesem Verfahren arbeitet, produziert seit
dem Jahr 2003 um die 215000 Tonnen Chlor pro Jahr. [Literatur
7] Der Energieverbrauch
ist um 15% niedriger im Vergleich zur alten Diaphragma-Anlage. Außerdem
entsteht reine, von Natriumchlorid freie Natronlauge. Das Verfahren funktioniert
nur mit hochreiner Sole, die nur sehr wenig Calcium- und Magnesium-Ionen
enthalten darf. Der Solekreislauf findet nur im Anodenraum statt. Eine
hochspezialisierte Membran ersetzt das Diaphragma. Durchlässig sind
nur Na+-Ionen, die von einer Hydrathülle umgeben sind.
Die Membran ist für sämtliche Anionen wie Cl− und
OH−-Ionen, sowie für Gase praktisch undurchlässig.
Die Membran besteht aus dem Polymer Nafion, das auf einem Gerüst aus
Teflon aufgebracht ist. [Literatur
1]
Literatur
1
Behr/Agar/Jörissen (2010): Einführung
in die Technische Chemie, Heidelberg
2 Jörissen, J. (2006): Chlor, Natronlauge und anderes aus Elektrolyseverfahren,
auf www.aktuelle-wochenschau.de der Gesellschaft Deutscher Chemiker
3 Hamann/Vielstich (2005): Elektrochemie, Weinheim
4 Binder (1999): Lexikon der chemischen Elemente, Stuttgart/Leipzig
5 Hollemann/Wiberg (2007): Lehrbuch der anorganischen Chemie, Berlin/New York
6 Glöckner/Jansen u.a. (1994): Handbuch der experimentellen Chemie, Band 6 Elektrochemie, Köln
7 Trueb, Lucien F. (2005): Die chemischen Elemente, Stuttgart
2 Jörissen, J. (2006): Chlor, Natronlauge und anderes aus Elektrolyseverfahren,
auf www.aktuelle-wochenschau.de der Gesellschaft Deutscher Chemiker
3 Hamann/Vielstich (2005): Elektrochemie, Weinheim
4 Binder (1999): Lexikon der chemischen Elemente, Stuttgart/Leipzig
5 Hollemann/Wiberg (2007): Lehrbuch der anorganischen Chemie, Berlin/New York
6 Glöckner/Jansen u.a. (1994): Handbuch der experimentellen Chemie, Band 6 Elektrochemie, Köln
7 Trueb, Lucien F. (2005): Die chemischen Elemente, Stuttgart