 |
Farbloses oder weißes, kristallinesPulver Natürliche Vorkommen Mineralien, die als Doppelsalze vorkommen, z.B. Polyhalit oder Schönit |
Molmasse 174,260 g/mol AGW keine Angaben Dichte 2,66 g/cm3 Schmelzpunkt +1069 °C Wasserlöslichkeit 100g H2O lösen bei 20 °C 11,11 g |
| - | - | Entsorgung G 4 |
| Etikett drucken | Deutscher Name | Englischer Name |
| CAS 7778-80-5 | Kaliumsulfat | Potassium sulfate |
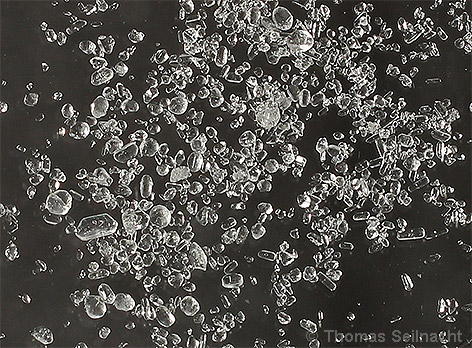
| Eigenschaften Kaliumsulfat wird
als weißes, kristallines Pulver gehandelt. Die orthorhombischen
Kristalle sind relativ hart und sehr beständig an der Luft. Sie
schmecken salzig bitter. Kaliumsulfat ist einigermaßen gut
wasserlöslich, die Lösung reagiert neutral. In Ethanol
löst es sich nicht.
 |
| Herstellung Kaliumsulfat war
schon den Alchimisten bekannt, die es aus den natürlich
vorkommenden Mineralien gewannen. Die erste Herstellung auf chemischem
Weg gelang Johann Rudolph Glauber im 17. Jahrhundert, vemutlich durch
das starke Erhitzen von Kaliumchlorid mit Schwefelsäure:
2 KCl + H2SO4 Die industrielle Gewinnung erfolgt durch die Reaktion von Magnesiumsulfat mit Kaliumchlorid.
Magnesiumsulfat ist aus dem Mineral Kieserit zugänglich. Bei der
Reaktion entsteht als Zwischenprodukt das Doppelsalz MgSO4•K2SO4. Die Gesamtreaktion stellt sich so dar:
MgSO4 + 2 KCl |
| Verwendung Kaliumsulfat ist Bestandteil vieler Düngemittel. Es dient auch zur Darstellung anderer Kaliumverbindungen wie Kaliumcarbonat oder Kaliumaluminiumsulfat.
Es ist als Lebensmittelzusatzstoff E515 als Festigungsmittel oder
Säureregulator zugelassen. In Löschpulvern der Brandklassen B
und C ist es ebenfalls enthalten. |