Quecksilber(II)-chlorid HgCl2
 Teflonverschluss |
Weißes, kristallines Pulver |
Molmasse 271,50 g/mol
AGW 0,02mg/m3 E (TRGS 900) Schmelzpunkt 277 °C Dichte 5,6 g/cm3 Wasserlöslichkeit 100g H2O lösen bei 20 °C 6,61 g |
| Piktogramm
GHS 05 GHS 06 GHS 08 GHS 09 Gefahr |
Gefahrenklassen
+ Kategorie
Akute Toxizität oral 1 Akute Toxizität dermal 1 Ätz-/Reizwirkung auf die Haut 1B Schwere Augenschädigung 1 Keimzellenmutagenität 2 Reproduktionstoxizität 2 Spez. Zielorgantoxizität wiederh. 1 Gewässergefährdend akut/chron. 1 |
HP-Sätze
(siehe Hinweis) H 300, 310, 314, 318, 341, 361FD, 372, 410 P 273, P280.1-4+6+7, P301+330+331, 309+310, 305+351+338, 303+361+353, 405 Entsorgung Besondere Hinweise |
| Deutscher Name | Englischer Name | |
| CAS 7487-94-7 | Quecksilber(II)-chlorid Sublimat |
Mercury(II) chloride Sublimate |
|
Bemerkungen
für Schulen: Quecksilber(II)-chlorid ist ein sehr toxisches,
wasserlösliches Quecksilbersalz, das leicht vom Körper
aufgenommen wird. Schon etwa ein halbes Gramm kann für einen
erwachsenen Menschen tödlich wirken. Es wird vom Autor aufgrund des sehr hohen
Gefahrenpotenzials empfohlen, diesen Stoff an Schulen nicht aufzubewahren und nicht zu verwenden.
Eigenschaften Quecksilber(II)-chlorid
ist ein schweres, weißes, kristallines Salz, das beim Erhitzen
leicht sublimiert, da der Schmelz- und Siedepunkt nahe beisammen liegen.
Der alte Name „Sublimat“ geht auf diese Eigenschaft zurück. Das
Salz ist in Wasser, in verschiedenen Alkoholen, in Aceton und in
Essigsäure löslich.
 Tödliche Dosis Quecksilber(II)-chlorid Quecksilber(II)-chlorid und auch die wässrige Lösung reagieren mit Metallen wie Kupfer oder Aluminium unter Bildung von Quecksilber
und dem entsprechenden Amalgam. Aluminiumfolie wird zum Beispiel durch die Lösung zerstört, weil das entstehende Quecksilber zunächst ein Aluminiumamalgam bildet, das sehr reaktionsfähig ist und am Luftsauerstoff zu weißem Aluminiumoxid reagiert:
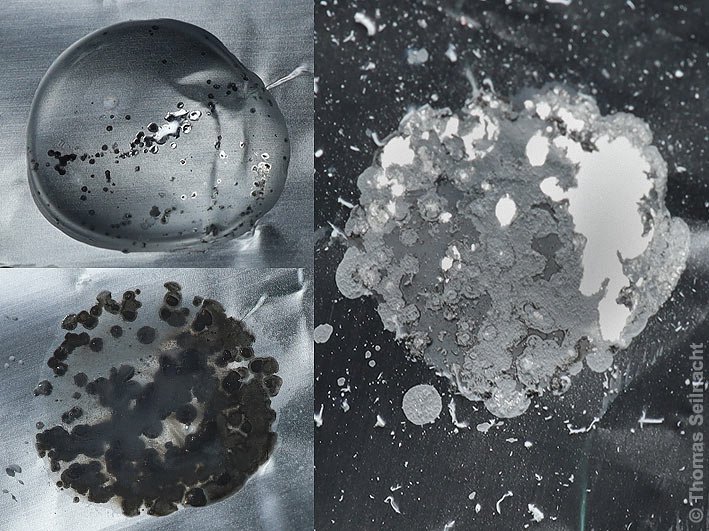 Eine Quecksilber(II)-chlorid-Lösung reagiert mit Aluminium. |
|
Herstellung
Quecksilber(II)-chlorid könnte man in einer ziemlich gefährlichen Reaktion direkt aus den Elementen Quecksilber und Chlor
herstellen. Beim Erhitzen von Quecksilber(II)-sulfat mit Natriumchlorid
entsteht Natriumsulfat und Quecksilber(II)-chlorid, das relativ leicht
abdestilliert werden kann. Die einfachste Methode ist das Auflösen
von Quecksilber(II)-oxid in Salzsäure:
HgO + 2 HCl |
|
Verwendung
Früher gab es in der
Apotheke „Sublimat-Pastillen“ als Desinfektionsmittel. Diese bestanden aus einen Gemisch von
Quecksilber(II)-chlorid mit Natriumchlorid und einem rötlichen
Farbstoff. Heute ist diese Anwendung verboten. Ein Verbot gilt auch
für die frühere Anwendung als pilztötendes Mittel in
Saatgut oder zur Holzimprägnierung.
Quecksilber(II)-chlorid eignet sich zum Ätzen von Kupfer oder Stahl oder als Katalysator für chemische Synthesen. Allerdings wird der Einsatz von Quecksilberverbindungen in der Industrie heute vermieden oder er ist ganz verboten. Aus Quecksilber(II)-chlorid und Kaliumiodid kann man in einer mehrstufigen Reaktion unter Verwendung von Natronlauge „Nesslers Reagenz“ herstellen. Der enthaltene Komplex K2[HgI4] bildet mit Ammoniak einen rotbraunen Komplex. Es lassen sich damit geringste Ammoniak-Konzentrationen nachweisen. Aufgrund der Toxizität von Quecksilberreagenzien werden heute andere Nachweisverfahren zum Nachweis von Ammoniak eingesetzt. |