a) Ionenbildung der Salze durch Elektronenwanderungen
Allgemein versteht man unter Ionen geladene Atome oder Atomgruppen. Sie spielen in der Natur eine bedeutende Rolle. Es kommen viele Mineralien vor, die zum Beispiel würfelförmige Kristalle ausbilden. Die Kristalle von diesen Mineralien sind nicht geschliffen oder nachbearbeitet, sie sind auf natürliche Art und Weise so gewachsen. Im Steinsalz werden die Würfel aus Natriumchlorid gebildet, im Bleiglanz aus Bleisulfid, im Pyrit aus Eisen(II)-disulfid und im Fluorit aus Calciumfluorid:
All diese Mineralien sind aus Salzen aufgebaut. Salze können im Labor auch künstlich hergestellt werden: Hält man zum Beispiel erwärmtes Natrium in einen Zylinder mit Chlorgas, entsteht in einer lebhaften Reaktion das weiße Salz Natriumchlorid.
Das Element Natrium steht in der ersten Gruppe des Periodensystems. Ein Natrium-Atom besitzt ein Valenzelektron auf der Valenzschale. Dieses Elektron kann leicht abgegeben werden. Chlor steht in der 17. Gruppe der „Salzbildner“. Chlor-Atome haben sieben Valenzelektronen in der Valenzschale. Sie benötigen nur noch ein Elektron, um die Edelgaskonfiguration mit acht Valenzelektronen zu erreichen. Bei der Reaktion von Natrium und Chlor wandert das Elektron aus der Valenzschale des Natrium-Atoms in die Valenzschale des Chlor-Atoms. Durch die Elektronenabgabe wird das Natrium-Atom positiv geladen, es wird zu einem Natrium-Ion Na+. Das Chlor-Atom hat ein Elektron aufgenommen und erhält dadurch eine negative Ladung. Es wird zu einem Chlorid-Ion Cl−.
Der Ionen-Begriff ist vom griechischen Wort ión (das Wandernde) abgeleitet. Positiv geladene Ionen werden als Kationen bezeichnet, sie entstehen, wenn Atome Elektronen abgeben. Negativ geladene Ionen bezeichnet man als Anionen, sie entstehen, wenn Atome Elektronen aufnehmen. Die Ladungsunterschiede bewirken eine elektrostatische Anziehungskraft zwischen den beiden Ionen. Es entsteht eine Ionenbindung. Die Ionenladung zeigt an, wie viele positive oder negative Ladungen ein Ion besitzt. Sie wird durch eine rechts neben dem Ion hochgestellte, arabische Zahl angegeben. Ist die Ladung nur einfach, wird nur ein Plus- oder ein Minuszeichen geschrieben. Zusammengesetzte Ionen können mit einer eckigen Klammer umfasst werden.
| Na+ |
Mg2+ | Cl− | [SO4] 2− |
| Natrium-Ion |
Magnesium-Ion | Chlorid-Ion |
Sulfat-Ion |
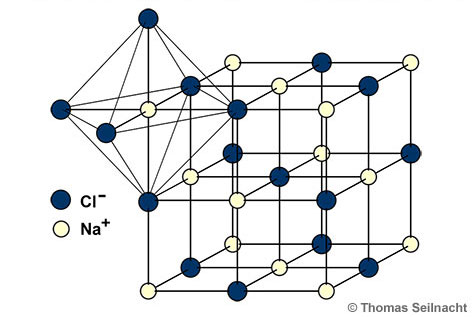
Die Ionen bilden ein regelmäßiges Ionengitter. Bei der Natriumchloridstruktur ist im Ionengitter jedes Na+-Ion von sechs Cl−-Ionen oktaedrisch umgeben (in der Grafik verdeutlicht). Gleichzeitig ist auch jedes Cl−-Ion von sechs Na+-Ionen oktaedrisch umgeben. Salze, die nach der Natriumchloridstruktur kristallisieren, können nicht nur Würfel, sondern auch Oktaeder ausbilden.
Wird Natriumchlorid im
Wasser gelöst, bleiben die Ionen erhalten, sie schwimmen dann frei
als Ladungsträger in der Lösung. Aus diesem Grunde leitet
salzhaltiges Wasser den elektrischen Strom, während reines,
destilliertes
Wasser fast keinen Strom leitet. Der Zerfall
des Ionengitters in frei bewegliche Na+- und Cl−-Ionen beim Lösungsvorgang
ist eine Dissoziation. Etwas vereinfacht formuliert versteht
man unter einer Dissoziation den Zerfall einer chemischen Verbindung in zwei oder mehrere Komponenten.
2.) Ionenbildung bei Säure- und Base-Reaktionen durch Protonenwanderungen
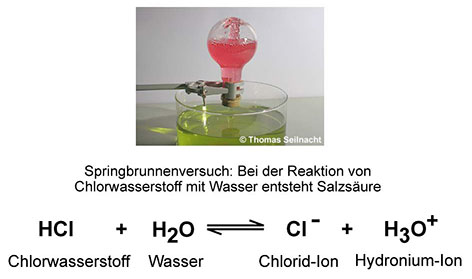
Bei der Reaktion der Säuren und Basen mit Wasser finden Protonenwanderungen statt. Wasser bildet beim Springbrunnenversuch mit Chlorwasserstoff Hydronium-Ionen H3O+ und mit Ammoniak Hydroxid-Ionen OH−. Ein Rundkolben ist mit Chlorwasserstoff gefüllt. Hält man ihn umgekehrt mit einer Düse versehen in Wasser, saugt der Chlorwasserstoff begierig Wasser in den Kolben. Beim Lösen im Wasser bilden sich positiv geladene Hydronium-Ionen und negativ geladene Chlorid-Ionen. Diese Ionen schwimmen in der gebildeten Chlorwasserstoff-Lösung, der Salzsäure, und ermöglichen den Ladungsaustausch innerhalb der Flüssigkeit.
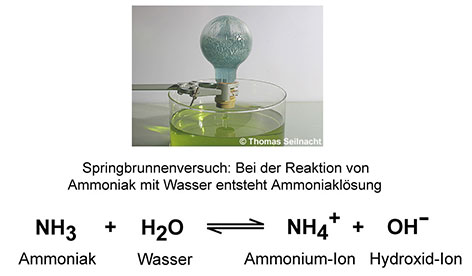
Bei der zweiten Variante des Springbrunnenversuchs, beim Lösen von Ammoniak in Wasser, bilden sich positiv geladene Ammonium-Ionen und negativ geladene Hydroxid-Ionen. Man erhält Ammoniaklösung, die ebenfalls elektrischen Strom leitet.
Weitere Informationen
Powerpoint-Präsentationen zum Thema
Buch individuell erstellen: Basis-Text Ionen und Ionenbindung


> Inhaltsverzeichnis
Powerpoint-Präsentationen zum Thema
Buch individuell erstellen: Basis-Text Ionen und Ionenbindung


> Inhaltsverzeichnis