Vorführungen nur durch Lehrkräfte
Inhalt
Didaktische Bemerkungen Demonstration 1 Ein farbloses und leichtes Gas Demonstration 2 Der Wasserstoff-Ballon Demonstration 3 Die Böllerbüchse Demonstration 4 Knallgas-Probe Demonstration 5 Die Wasserstoff-Orgel Demonstration 6 Synthese von Wasser: Verbrennungsprodukte des Wasserstoffs Demonstration 7 Analyse von Wasser durch Elektrolyse Demonstration 8 Brennstoffzellen und Wasserstofftechnologie Demonstration 9 Herstellung von Wasserstoff aus Magnesium und Wasserdampf Am Wasserstoff – dem Element Nummer 1 im Periodensystem – lassen sich viele Stoffeigenschaften aufzeigen, die nicht alltäglich
sind und zum Staunen anregen. Wasserstoff ist das Element
mit der geringsten Dichte. Es ist 14,4 mal leichter als Luft und bildet
mit Luft explosionsfähige Gemische. Die Verbrennung von Wasserstoff
stellt eine besondere Form der Oxidation dar.
In der Technik besitzt das Gas eine zukunftsweisende Bedeutung. Wasserstoff
steht zwar in der ersten Hauptgruppe des Periodensystems, wird aber nicht
zu den Alkalimetallen gezählt. All diese Gründe prädestinieren
den Wasserstoff, ihn als erstes Element des Periodensystems ausführlich
zu behandeln.
Zunächst zeigt man die Gasflasche, weist auf die rote Farbe hin und erläutert die Funktionsweise der verschiedenen Ventile. Beim Ausströmen des Wasserstoffs ist zunächst nichts zu sehen. Auch durch das Riechen an dem ausströmenden Gas lässt sich der Wasserstoff nicht kennzeichnen. Nun steckt man eine kurze Glasröhre (d = 8 mm) auf den Schlauch, taucht das Ende der Röhre in eine Seifenblasen-Lösung und lässt vorsichtig Gas ausströmen. Beobachtungen: Mit ein wenig Geschick lassen sich viele Seifenblasen erzeugen, die alle sehr zügig nach oben in Richtung Decke aufsteigen. Bei der Frage nach Verwendungsmöglichkeiten für dieses Gas, nennen die Schüler vielleicht schon das Luftschiff oder den Ballon. Dies führt auf die Demonstration 2 hin: Ein roter Luftballon wird satt mit Wasserstoff gefüllt, mit einem Knoten verschlossen und an einer dünnen Nylonschnur befestigt. Danach nähert man sich vorsichtig mit einem brennenden Holzspan. Achtung: Kopf fernhalten und Schutzhandschuhe aus Leder tragen! Auf Brandschutz im Raum achten! Bei der Zündung Mund weit öffnen, auch Zuschauer! Alle im Raum tragen Schutzbrillen! Beobachtungen:
Das Gas zieht den Ballon deutlich nach oben.
Bei der Zündung zerplatzt der Ballon und das Wasserstoffgas verbrennt
in einem großen Feuerball.
Variationen:
Man füllt mehrere Ballons mit Wasserstoff
und befestigt an Schnüren Zettel mit Botschaften der Schüler.
Dann geht man ins Freie und lässt die Ballons fliegen. Das Aufsteigen
der Ballons wird genau beobachtet. Vom Füllen des Ballons mit Wasserstoff-Luft-Gemischen
oder mit Wasserstoff-Sauerstoff-Gemischen ist dringend abzuraten!
Ergänzende Informationen: Das Luftschiff Hindenburg flog im Mai 1937 von Frankfurt nach New York. Kurz vor der Landung am 6. Mai, beim Anflug auf den Ankermast, fing der Lack der Außenhaut durch eine elektrostatische Entladung Feuer und begann zu brennen. Das Feuer breitete sich aus und griff auf die Gastanks über, so dass sich der ausströmende Wasserstoff entzündete. Innerhalb von 30 Sekunden stand das 245 Meter lange Luftschiff in Flammen und stürzte als riesiger Feuerball zu Boden. 32 Menschen starben, wie durch ein Wunder überlebten 62 Passagiere und Besatzungsmitglieder. Diese Demonstration
sollte
gut vorbereitet werden, da die Gefahr besteht, dass der Inhalt der
Büchse
schon direkt beim Zünden explodiert. Der Kopf ist dabei
fernzuhalten. Büchsen mit scharfen Kanten dürfen nicht
verwendet werden. Die Büchse darf während des Füllens und auch danach niemals angehoben werden (sondern
höchstens leicht gekippt), weil sonst Luft durch Verwirbelungen
hineingelangt! Die Schüler
sind vor einem Knall zu warnen und sollten sich während der Demonstration
völlig ruhig verhalten. Alle Beteiligten im Raum inklusive Lehrkraft tragen Schutzbrillen und müssen den Mund weit öffnen, sie halten genügend Sicherheitsabstand, am besten am hinteren Ende
des
Raumes. Zum Erstellen einer Gefährdungsbeurteilung unbedingt
Bemerkungen zum Gehörschutz beachten! Für die Lehrkraft wird das Tragen eines Gehörschutzes generell empfohlen, wenn ein Knall auftritt, weil eine Unbedachtsamkeit
zu einem Knalltrauma führen kann, wenn sie zu nahe dabei steht.
Eine hohe und unten offene Blechbüchse mit etwa 1,5 Liter Inhalt wird oben mit einem 2 Millimeter großen Loch durchbohrt. Dann legt man alle benötigten Geräte auf den Tisch, wo die Demonstration vorgeführt werden soll: Die Büchse wird mit der Öffnung nach unten mit einer Kante auf ein Streichholz gestellt, der Brenner und ein Holzspan liegen bereit. Die Gasflasche wird zur Entnahme von Wasserstoff vorbereitet. Der Brenner wird entzündet. 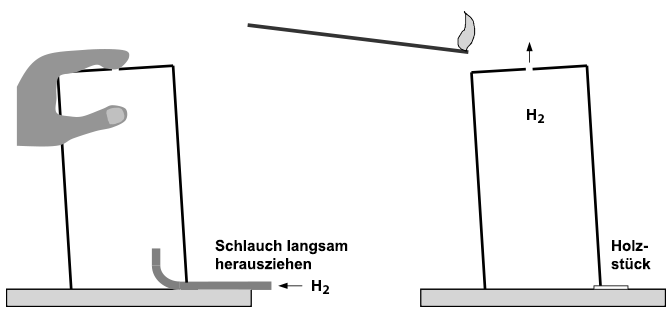 Nun stellt man die Büchse
ein wenig schräg und schiebt den Schlauch von der Gasflasche in die
Büchse. Das Loch wird mit einem Finger verschlossen. Danach lässt
man Wasserstoff langsam in die Büchse strömen. Da dabei mit einem
Übermaß Wasserstoff gearbeitet wird, damit die Büchse
auch wirklich voll ist, muss unbedingt die Raumlüftung eingeschaltet sein.
Nach dem Entfernen des Schlauchs wird der Finger vom Loch der Büchse
weggenommen und der ausströmende Wasserstoff am besten mit einem langen Gasanzünder gezündet.
Beobachtungen:
Zunächst verbrennt der oben aus dem Loch
ausströmende Wasserstoff mit ruhiger Flamme. Nach etwa einer Minute ist
ein hoher Ton wahrnehmbar, der allmählich tiefer wird, während
sich die Flamme langsam in die Büchse zurückzieht. Plötzlich
explodiert der Inhalt der Büchse mit einem Knall, wobei die
Büchse angehoben wird. Eine Flamme schlägt dabei unten aus der
Büchse. Danach fühlt sie sich warm an und ist innen
für kurze Zeit mit einem Beschlag benetzt.
Erklärungen: Beim Ausströmen und Verbrennen des Wasserstoffs füllt sich die Büchse von unten her allmählich mit Luft. Nach einer Weile entsteht ein explosionsfähiges Wasserstoff-Luft-Gemisch, das durch die sich hineinziehende Flamme gezündet wird. Ein Glasrohr mit sauberer Düse und Rückschlagsicherung (Eisenwolle) wird an einem Stativ befestigt und mit dem Entnahmeschlauch der Wasserstoff-Flasche verbunden. Die Raumlüftung muss laufen! Dann leitet man einen schwachen Wasserstoff-Strom durch die Düse und führt zweimal eine Knallgasprobe durch: a) Entnahme von Wasserstoff in einem umgekehrten Reagenzglas direkt nach dem Öffnen des Gasventils und Durchführung der Knallgas-Probe (siehe Film) b) Entnahme nach einer Weile und erneute Durchführung der Knallgas-Probe Fällt die Knallgas-Probe
negativ aus oder ist nur ein „Blupp“ zu hören und brennt der Wasserstoff
ruhig in das Reagenzglas, dann kann der ausströmende Wasserstoff an
der Düse gezündet werden. Bei einem lauten „Pfiff“ darf noch
nicht gezündet werden. Der Pfiff kann auch absichtlich herbeigeführt
werden, wenn man das Reagenzglas nicht ganz voll mit Wasserstoff füllt.
Freiwillige können die Knallgas-Probe
dann selbst vorführen. Im Anschluss an diese Demonstration eignet
sich auch die Durchführung der Schülerübung „Herstellung
von Wasserstoff“.
Achtung: Dieser Versuch ist nur für erfahrene Lehrkräfte geeignet, alternativ kann ein Film gezeigt werden. Schutzbrillen und Schutzscheibe sind notwendig.
Eine mindestens 3 Zentimeter dicke und 0,6 Meter lange Glasröhre
aus Quarzglas wird senkrecht in ein Stativ
gespannt. Man entzündet an einer Düse ausströmenden Wasserstoff
(siehe Demonstration 4) und schiebt die Düse mit der brennenden Flamme
von unten in das Glasröhre. Durch Regulieren des Gasstroms wird die
Höhe der Flamme größer und dann wieder kleiner gestellt.
Beobachtungen: Je nach Größe der Röhre entsteht ein Ton, der durch die Flammenhöhe geringfügig moduliert werden kann. Erläuterungen: Das Phänomen wurde im Jahre 1777 von dem englischen Arzt Bryan Higgins (1737–1818) erstmals entdeckt. Die in einem Rohr singende Wasserstoff-Flamme wurde bald als „chemische Harmonika“ in vielen Vorlesungssälen vorgeführt. Selbst Johann Wolfgang von Goethe war von der Demonstration begeistert. Die Erklärung für das Phänomen lieferte Michael Faraday im Jahre 1818: Beim Verbrennen von Wasserstoff entstehen viele kleine Knallgasexplosionen, die die Luftsäule im Rohr zum Schwingen anregen. Im Jahre 1882 wurden in Paris sogenannte „Lustres chantantes“ gebaut, orgelähnliche Tasteninstrumente mit gläsernen Röhren, in denen Wasserstoff-Flammen Töne erzeugten. Aufgrund der akuten Knallgas-Gefahr konnte sich die Wasserstoff-Orgel jedoch nicht durchsetzen. Zu
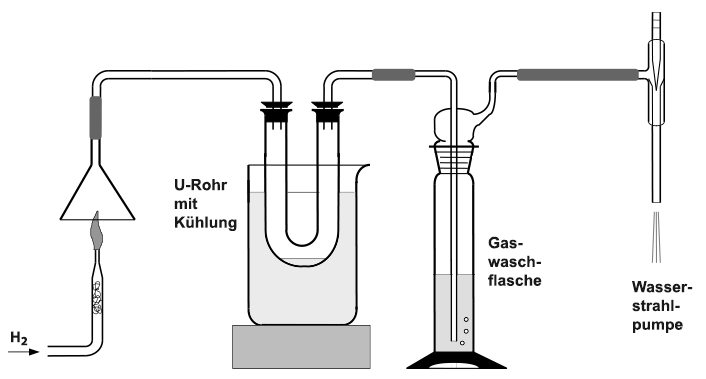
diesem Versuch liegt auch ein Arbeitsblatt vor Zunächst werden alle
benötigten Geräte (siehe Grafik unten) auf den Experimentiertisch
gelegt, so dass alle beteiligten Schüler die Geräte deutlich
sehen. An einer Düse wird ausströmender Wasserstoff nach negativer
Knallgasprobe entzündet. Nun hält man für kurze Zeit einen
kalten Rundkolben aus Duranglas in die Flamme.
Auf der Außenseite
bildet sich ein Beschlag, der nach einigen Sekunden wieder weggeht oder
mit einem Lappen weggewischt werden kann. Die Schüler äußern
nun Vermutungen über den Beschlag. Dabei ergeben sich Fragen, zum
Beispiel:
 Nach dem Einschalten
der Wasserstrahlpumpe wird durch die Apparatur Luft gesaugt. Die Schüler
sehen das Sprudeln in der Gaswaschflasche. Nun stellt man die Wasserstoff-Flamme
unter den Trichter und fährt die Hebebühne mit dem Kühlwasser
hoch, so dass das U-Rohr gekühlt wird.
Beobachtungen: Im U-Rohr bildet sich ein wasserähnlicher Beschlag. Nach einer Weile formen sich Tröpfchen, die sich am Boden sammeln. Hat sich ein Bodensatz einer Flüssigkeit gebildet, schaltet man die Wasserstrahlpumpe aus und entfernt die Wasserstoff-Flamme. Mit Hilfe von weißem Kupfer(II)-sulfat oder mit Wassernachweispapier („Watesmo“) kann bewiesen werden, dass es sich um Wasser handelt. Theorie: Bei der Verbrennung des Wasserstoffs entsteht Wasserstoffoxid, das den Schülerinnen und Schüler als Wasser bereits bekannt ist. Dieser Vorgang ist exotherm, da dabei Energie frei wird. Die Herstellung eines Stoffes durch eine Stoffvereinigung nennt man Synthese: Wasserstoff +
Sauerstoff
2 H2 + O2 Bei der Synthese von
Wasser wurde aus Wasserstoff und Sauerstoff in einer exothermen Reaktion
das Wasser gebildet. Es stellt sich nun die Frage, ob dieser Vorgang
auch
umkehrbar ist. Zur Durchführung
der Demonstration wird ein Hofmannscher Wasserzersetzungsapparat mit
10%iger
Schwefelsäure gefüllt. Auf die Platinelektroden gibt man 15
Volt Gleichspannung und wartet ab, bis eine größere Gasmenge
entstanden ist. Die Schüler werden befragt, wie sie die
Beobachtungen
interpretieren.
Beobachtungen: An beiden Platinelektroden steigen Bläschen auf. Am oberen Ende der Gassammelrohre sammeln sich durch Wasserverdrängung Gase, wobei an der mit dem Minuspol verbundenen Elektrode etwa die doppelte Gasmenge entsteht. Der entstehende Wasserstoff lässt sich mit der Knallgasprobe nachweisen. Der an der mit dem Pluspol verbundenen Elektrode entstehende Sauerstoff wird mit der Glimmspanprobe nachgewiesen: Man öffnet den Hahn vorsichtig und hält einen glimmenden Holzspan an das ausströmende Gas. Dabei ist ein kurzes Aufflammen zu beobachten. Theorie: Bei der Zerlegung von Wasser durch Elektrolyse entstehen die Gase Wasserstoff und Sauerstoff. Da dabei ständig Energie in Form von elektrischem Strom zugegeben werden muss, handelt es sich bei dem Vorgang um eine endotherme Reaktion. Die Zerlegung eines Stoffes nennt man Analyse: Wasser
2 H2O Der Hofmannsche Wasserzersetzungsapparat
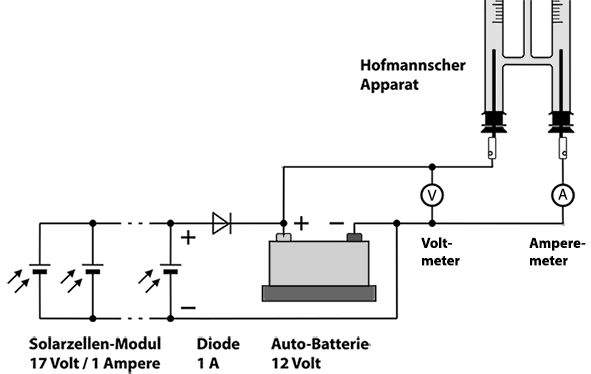
kann mit Hilfe eines großen Solarzellenmoduls betrieben werden. Der
Wasserstoff dient dabei als Energiespeicher (Näheres siehe >Wasserstofftechnologie).
Die Apparatur wird so aufgebaut, dass die Solarzellen eine 12-Volt-Autobatterie
aufladen, wenn der Hofmannsche Apparat nicht angeschlossen ist. Zur direkten
Entnahme des Stroms von den Solarzellen werden von der Batterie die Steckverbindungen
abgezogen. Zum Schutz der Solarzellen wird eine Diode zwischen Batterie
und Solarzellen geschaltet. Diese verhindert das Zurückfließen
des Stroms von der Batterie zu den Solarzellen (siehe Schaltplan).
Die Apparatur verdeutlicht
das Prinzip der Energiespeicherung: Sie ermöglicht die Produktion
von Wasserstoff auch wenn keine Sonne scheint.
 Verwendet man am Hofmannschen
Apparat keine Platin-Elektroden, sondern Graphit-Elektroden, tritt nach der
Elektrolyse ein Phänomen auf, wenn man an den Elektroden eine Spannungsmessung
vornimmt. Dabei lässt sich eine Spannung von etwas mehr als einem
Volt messen, die längere Zeit anhält und mit der man sogar einen
Solarmotor betreiben kann. Die porösen Elektroden speichern bei der
Elektrolyse die entstehenden Gase, so dass eine echte Brennstoffzelle vorliegt,
solange die Gase noch darin enthalten sind. Das Phänomen tritt theoretisch
auch bei Platin-Elektroden auf, allerdings nicht so deutlich. Auch bei einer
Elektrolyse von 10%iger Schwefelsäure in einem U-Rohr mit Seitenrohren
ist das Phänomen nach der Elektrolyse deutlich messbar.
Diese Elektrolyse-Apparatur funktioniert auch einige Zeit lang als Brennstoffzelle. Demonstration 9 Herstellung von Wasserstoff aus Magnesium und Wasserdampf Achtung: Es darf nur mit minimalen Mengen Magnesium gearbeitet werden. Keinesfalls
darf man den Wasserstoff direkt an der Düse entzünden. Der
Wasserstoff-Nachweis erfolgt durch die Knallgas-Probe mit dem im kleinen
Reagenzglas aufgefangenen Gas. Das gebogene Reagenzglas muss aus Quarzglas gefertigt sein. Schutzbrille tragen!
Zuerst hält man das völlig trockene, gebogene Reagenzglas aus Quarzglas senkrecht. Mit Hife eines Trichters füllt man es zwei Zentimeter hoch mit Sand. Mit Hilfe einer langen Pipette befeuchtet man den Sand mit Wasser, ohne dass die anderen Stellen im Reagenzglas feucht werden. Danach spannt man das Reagenzglas waagerecht in ein Stativ. Ein 10 Zentimeter langes Magnesium-Band wird zerknüllt und mit Hilfe einer langen Pinzette in die Mitte des Reagenzglases gelegt. Alternativ kann man auch mit einem Glühschiffchen und wenig Magnesium-Pulver arbeiten. Dann setzt man den Stopfen mit dem gebogenen Glasrohr und der langgezogenen Düse auf und stellt das kleine Reagenzglas 16 × 160 mm auf die Düse. Zuerst wird das Magnesium-Band mit der rauschenden Brenner-Flamme bis zum Glühen erhitzt. Danach erhitzt man sofort den Sand, so dass Wasserdampf über das glühende Magnesium strömt. Man wartet ab, bis die Reaktion abgeschlossen ist und führt danach die Knallgas-Probe mit dem Gas im kleinen Reagenzglas durch. 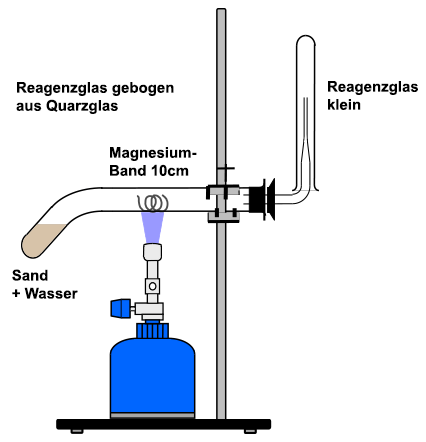 Sobald Wasserdampf über das glühende
Magnesium strömt, glüht dieses hell auf. Gleichzeitig entsteht ein
weißer Rauch. Die Knallgas-Probe verläuft positiv. Der Wasserdampf hat mit dem
Magnesium zu Wasserstoff und Magnesiumoxid reagiert:
Magnesium + Wasser Mg + H2O
Reinigung des Reagenzglases: Zuerst spült und putzt man das erkaltete Quarz-Reagenzglas gut mit Wasser und einer Bürste. Dann wird es im Abzug senkrecht in ein Stativ gespannt und mit 10%iger Salzsäure gefüllt. Unbedingt Schutzbrille tragen!
Es entstehen Gasbläschen, die aufsteigen und sich bei Luftkontakt
spontan mit einem kleinen Knall entzünden. Das Reagenzglas ist
gereinigt, sobald keine Gasentwicklung mehr stattfindet.
|