Chemische Zeichensprache
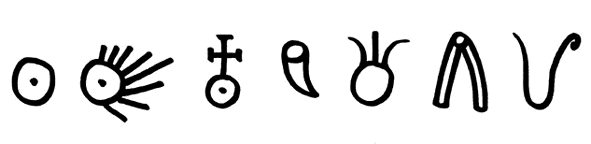
Damit sich Chemiker weltweit
verständigen können, gebrauchen sie eine gemeinsame Fachsprache,
die in der IUPAC-Nomenklatur (International Union of Pure and Applied Chemistry, Internationale Union für
Reine und Angewandte Chemie) einheitlich geregelt ist. Eine Symbolsprache
für die Chemie gab es schon im Mittelalter bei den Alchemisten. Dort
waren viele der Symbole so verschlüsselt, dass sie nur von Eingeweihten
gebraucht werden konnten. So gab es für das Gold zahlreiche
Symbole (siehe oben). Die heute für die Elemente gebräuchlichen
Symbole wurden ab 1811 im Wesentlichen von dem schwedischen Chemiker J. J. Berzelius geschaffen. Berzelius benutzte nur Buchstaben und Ziffern. Weitere Beispiele für gebräuchliche Symbole sind die GHS-Piktogramme, die Strahlen-Warnzeichen, die Warnzeichen, die Gebotszeichen oder die Verbotszeichen.
Die Elementsymbole kennzeichnen
in der Regel ein Atom eines Elements und in chemischen Gleichungen ein Mol des elementaren Stoffs. Bei chemischen Verbindungen
wird die Anzahl der beteiligten Atome durch Aufreihung der Buchstaben
und einer Zahl rechts nach unten versetzt angezeigt. In einem Molekül
Wasser H2O verbinden sich Wasserstoff- und Sauerstoffatome im
Verhältnis 2 zu 1. Diese Form der Darstellung mit Aufzählung der
Anzahl der Atome wird als Summenformel bezeichnet.
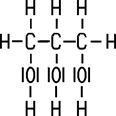
Die Summenformel gibt keinen Aufschluss über die Art und Weise, wie die Atome miteinander
verknüpft sind. Daher wird die sogenannte Lewis-Schreibweise eingeführt,
die die Valenzelektronen kennzeichnet. Tauchen in chemischen Gleichungen Punkte
für einzeln besetzte Orbitale auf, sind damit die sehr reaktionsfähigen
„Radikale“ gemeint, die in der Natur gelegentlich auftreten. Nach der Lewis-Schreibweise wird das einzelne Valenzelektron für die Atome der Elemente in der 1. Gruppe (I. Hauptgruppe) mit einem Punkt dargestellt: Die Atom-Symbole der Elemente der Gruppen
1 und 2, sowie 13 bis 18 (Hauptgruppen-Elemente) erhalten je nach Elektronenbesetzung
bis zu 8 Punkte. Immer zwei Punkte kennzeichnen ein Orbital. Dabei ist
zu beachten, dass die Orbitale stets der Reihe nach einfach besetzt werden.
Eine Doppelbesetzung findet erst statt, wenn alle Orbitale einfach besetzt sind:

Doppelt besetzte
Orbitale oder gemeinsam benutzte Elektronenpaare werden mit einem Strich
dargestellt. Ob die Bindungspartner eine Metallbindung, eine Ionenbindung oder eine Elektronenpaarbindung eingehen, hängt von den Partnern ab. Bei der Elektronenpaarbindung
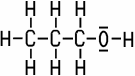
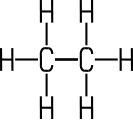
benutzen Moleküle gemeinsame Elektronenpaare. Die Strukturformel
zeigt die Art und Weise, wie Atome in einem Molekül miteinander
verknüpft
sind. Die einfache Strukturformel gibt allerdings keinen
Aufschluss über
tatsächliche räumliche Anordnungen und
Abstände zwischen
den Atomen, dies versucht die Stereochemie darzustellen.
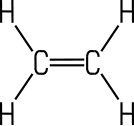
Der
Strich zwischen zwei Atomen verdeutlicht die einfache Elektronenpaarbindung. Eine Doppelbindung wird durch einen doppelten Strich und eine Dreifachbindung durch einen
dreifachen Strich angezeigt:
|