Die einfachste Möglichkeit
zum Nachweis von Wasserstoff-Atomen in einer
organischen Verbindung wäre das Erhitzen eines festen Kohlenwasserstoffs
oder von Zucker in einem Reagenzglas. Das entstehende Wasser beschlägt
sich oben am kalten Glasrand oder dampft aus dem Reagenzglas, es kann mit
Watesmo-Wasser-Nachweispapier nachgewiesen werden. Das Papier färbt
sich mit Wasser blau.
Es existieren auch andere
Möglichkeiten, um chemisch gebundenen Wasserstoff nachzuweisen: Man entzündet
einen Kohlenwasserstoff oder eine andere organische
Verbindung und hält in die Flamme einen kalten Rundkolben. Dabei
ist ein flüchtiger Beschlag von kondensiertem Wasser zu sehen. Dies
ist ein Hinweis auf vorhandene Wasserstoff-Atome im Kohlenwasserstoff.
Kohlenwasserstoff + Sauerstoff
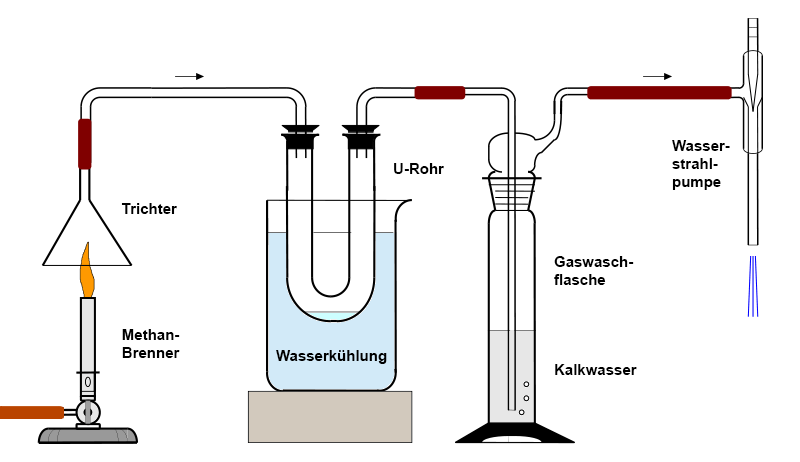
Zur Herstellung messbarer Mengen saugt man die Verbrennungsgase mit Hilfe eines Trichters und
einer Wasserstrahlpumpe ab und leitet die Gase durch ein wassergekühltes
U-Rohr. Im U-Rohr kondensiert das Wasser, das mit Watesmo-Papier oder mit
weißem, trockenem Kupfer(II)-sulfat nachgewiesen werden kann. Durch eine nachgeschaltete
Gaswaschflasche lässt sich das ebenfalls entstehende Kohlenstoffdioxid
mit Hilfe von Kalkwasser nachweisen:
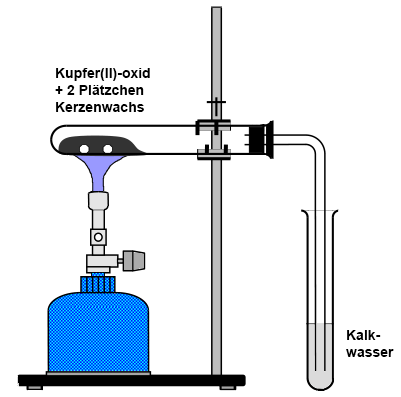
Man kann auch die zu
untersuchende Substanz mit schwarzem Kupfer(II)-oxid
in einem quer liegenden Reagenzglas erhitzen. Das kondensierte Wasser an den kühleren Stellen im Reagenzglas weist man mit weißem, wasserfreiem Kupfer(II)-sulfat
nach. Das entstehende Kohlenstoffdioxid wird mit einem Winkelrohr in ein
Reagenzglas mit Kalkwasser geleitet:
Theorie
Die Entstehung von Wasser
weist auf das Vorliegen von Wasserstoff-Atomen in der zu untersuchenden
Substanz hin. Weißes Kupfer(II)-sulfat
nimmt bei der Reaktion mit Wasser fünf Wasser-Moleküle in sein
Kristallgitter auf. Dabei entsteht ein blaues Pentahydrat CuSO4
•
5 H2O. Auf einem ähnlichen Vorgang beruht
die Verfärbung von blauviolettem Cobalt(II)-chlorid-Monohydrat zu rotviolettem Cobalt(II)-chlorid-Hexahydrat.
Bei der Reaktion des Kohlenwasserstoffs
mit Kupfer(II)-oxid wird dieses zu elementarem Kupfer reduziert, das man
an der roten Farbe erkennen kann. Die dabei frei werdenden Sauerstoffatome
oxidieren die Kohlenstoffatome des Kohlenwasserstoffs zu Kohlenstoffdioxid
und die Wasserstoffatome zu Wasser:
Reduktion: 2 CuO
Oxidation 1: C-Atome + "O"
Oxidation 2: H-Atome + "O"
Sicherheit
Beim Verkohlen von Stoffen und beim Arbeiten mit Wasserstoff oder mit Methangas ist auf eine gute Raumlüftung zu achten. Es muss eine Schutzbrille getragen werden. Beim Arbeiten mit ätzenden Stoffen wie Natriumhydroxid oder Natronlauge sind auch Schutzhandschuhe notwendig. Reste der Kupfersalze werden im Behälter für Schwermetallsalzlösungen entsorgt.