 |
 Hellgelbes, kristallines Pulver |
Molmasse 177,161 g/mol AGW keine Angaben Dichte keine Angaben Schmelzpunkt +330,5 °C Wasserlöslichkeit unlöslich |
| Piktogramme GHS 07 Achtung |
Gefahrenklassen
+ Kategorie Akute Toxizität oral 4 Ätz-/Reizwirkung auf die Haut 2 Augenreizung 2 Spez. Zielorgantoxizität e. (Atemwege) 3 |
HP-Sätze (siehe auch Hinweis) H 302, 315, 319, 335 P 261, 280.1-3, 302+352, 304+340, 305+351+338 Entsorgung G 3 |
| Etikett drucken | Deutsche Bezeichnung Synonym (deutsch) |
Engl. Bezeichnung Synonym (engl.) |
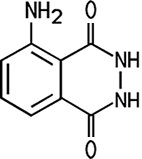
| CAS 521-31-3 |
Luminol 5-Amino-2,3-dihydro-1,4-phthalazindion 3-Aminophthalhydrazid |
Luminol 5-Amino-2,3-dihydro-1,4-phthalazinedione 3-Aminophthalhydrazide |
| Eigenschaften Luminol ist ein schwach gelbes, kristallines Pulver,
das in Wasser unlöslich ist. In organischen Lösungsmitteln
und in alkalischen, wässrigen Lösungen löst es sich. Mit
Luminol kann eine starke Chemolumineszenz demonstriert werden, wenn es
in alkalischer Lösung mit einem Oxidationsmittel wie Wasserstoffperoxid vermischt wird und Schwermetall-Ionen vorliegen.
 |
| Herstellung und Geschichte Zur Herstellung von Luminol wird Phthalsäure zunächst zu 3-Nitrophthalsäure nitriert, die man mit Natronlauge zum di-Natriumsalz umwandelt. Dieses wird
unter Erwärmung mit Hydrazinsulfat versetzt. Dabei entsteht
Nitrophthalsäurehydrazid, das dann mit Natriumdithionit zum Luminol
reduziert wird. |
| Verwendung Luminol wird im
Chemieunterricht zum Zeigen des Phänomens der Chemolumineszenz
benötigt. Dazu wird wenig Luminol in verdünnter Natronlauge gelöst und kurz vor der Reaktion mit einer Wasserstoffperoxidlösung vermischt. Als Katalysator wird Kaliumhexacyanoferrat(III) zugegeben, damit das blaue Leuchten entsteht. Die gleiche Reaktion dient in der Kriminalistik zum Nachweis von Blut. Bei der kriminaltechnischen Untersuchung auf Blutspuren dient der Häm-Komplex im Blut als Lieferant für die Schwermetall-Ionen. Die alkalische Luminollösung und die Wasserstoffperoxidlösung werden erst kurz vor dem Test vermischt und auf die zu prüfenden Objekte gesprüht. So können anhand des blauen Leuchtens geringste Blutspuren nachgewiesen werden. Beim Lösen in Natronlauge entsteht ein geladenes Luminol-Molekül, das dann durch Wasserstoffperoxid oxidiert wird. Das durch die Oxidation energiereiche Molekül befindet sich in einem angeregten Zustand. Nach dem Aussenden von Licht wird das Molekül wieder in den Grundzustand versetzt. |
