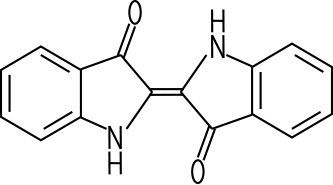
Indigo synthetisch C16H10N2O2
 |
 Dunkelblauviolettes Pulver Vorkommen Indigopflanze, Färberwaid |
Molmasse 262,262 g/mol
AGW keine Angaben Sublimationspunkt +300 °C Zersetzung +390 °C Dichte 1,2 g/cm3 Wasserlöslichkeit Konz. bei 25 °C 0,001 g/l |
| Piktogramm
GHS 08 Achtung |
Gefahrenklassen
+ Kategorie
Spez. Zielorgan-Toxizität w. 2 |
HP-Sätze
(siehe Hinweis) H 373 P 260, 280.1-3, 314 Entsorgung G 3 |
| Etikett drucken | Dt. Bezeichnung |
Engl. Bezeichnung |
| CAS 482-89-3 | Indigo synthetisch |
Indigo synthetic |
Hinweise zur Rechtsschreibung: Der Indigo oder das Indigo, beides ist korrekt.
|
Hinweise
für Schulen: Indigo synthetisch kann herstellungsbedingt Anilinspuren enthalten, oder es setzt in der Küpe Anilin
frei. Für dieses Indigo ist die Kennzeichnung oben angegeben.
Indigopulver kann die Augen reizen. Das Tragen einer Schutzbrille ist
notwendig, Schutzhandschuhe und ein Schutzkittel werden beim Färben
als Vorsichtsmaßnahme ebenfalls empfohlen, zumal für die
Verküpung sowieso ätzende Stoffe eingesetzt werden.
 Synthetischer Indigo als Pulver und natürlicher Indigo aus Indien in Blöcken Eigenschaften Reiner Indigo ist ein
geruchloses, dunkelblauviolettes Pulver, das kupferrot schimmert und in
Wasser nur ganz wenig
löslich ist. In Ethanol und Diethylether löst sich Indigo
nicht, dafür aber in Ethylacetat oder in heißem Aceton. In konzentrierter
Schwefelsäure löst er sich mit grüner, beim Erwärmen
mit blauer Farbe auf. Indigo ist nicht brennbar, er sublimiert
bei 300 °C und zersetzt sich bei 390 °C unter Bildung von
Stickoxiden, Kohlenstoffdioxid und Kohlenstoffmonooxid.
 Indigo sublimiert beim Erhitzen und resublimiert wieder am kalten Reagenzglas. Zum Färben wird der Küpenfarbstoff Indigo mit Natriumdithionit und Natronlauge zum wasserlöslichen Indigoweiß verküpt, das in der Küpe eine gelbliche Lösung bildet. Die Textilien werden in die entstehende Küpe getaucht. Beim Herausziehen oxidiert das gelbe Indigoweiß an der Luft zum blauen Indigo. 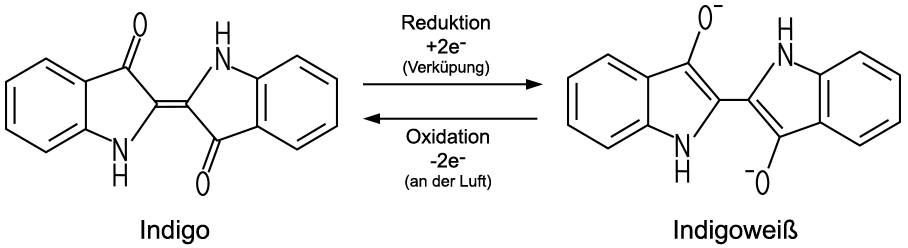 |
|
Herstellung
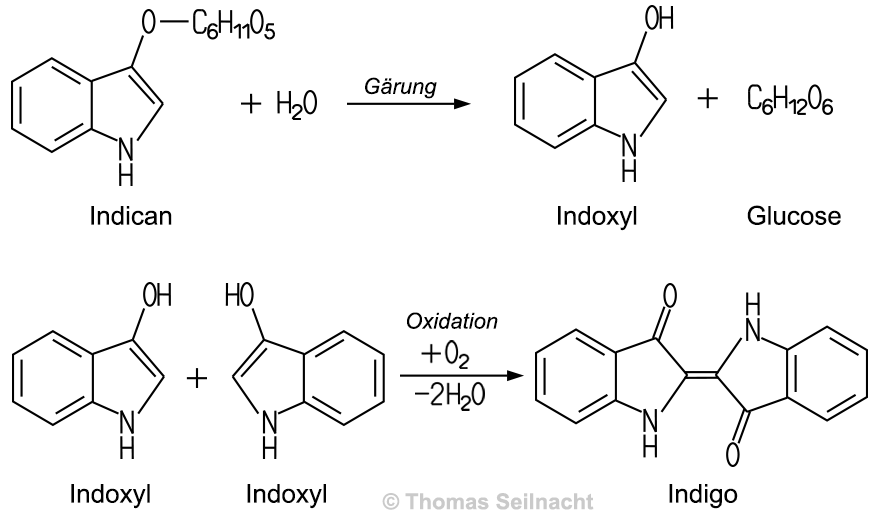
Natürlicher Indigo kann mit großem Aufwand aus dem Färberwaid oder aus der Indigopflanze
gewonnen werden. Die Indigopflanze enthält Indican, eine Vorstufe des Indigos. Durch
Gärung im Wasser wandelt sich Indican in Indoxyl und Traubenzucker
um. Beim Schlagen des Gärproduktes mit Luft oxidiert das Indoxyl mit dem Luftsauerstoff
zum Indigo:
 In den 1870er-Jahren gelang dem deutschen Chemiker Adolf von Baeyer (1835–1917) erstmals die künstliche Herstellung aus Isatin. Da dabei einige Nebenprodukte entstanden, entwickelte er ein verbessertes Verfahren zur Indigoherstellung aus 3-Nitropropionsäure. Dieses ließ er patentieren und verkaufte dann das Patent an die BASF. Die zusammen mit dem dänischen Chemiker Drewsen entwickelte Methode zur Herstellung von Indigo aus 2-Nitrobenzaldehyd und Aceton unter Zugabe von Natronlauge war für eine industrielle Herstellung ohne Bedeutung, da die Herstellung des ersten Ausgangsstoffs teuer und aufwändig ist. Dieses Verfahren wird an Schulen und Hochschulen gelegentlich als Beispiel für eine im Laborpraktikum durchführbare Indigosynthese herangezogen. Die durch eine Base katalysierte Aldol-Kondensation des Acetons mit 2-Nitrobenzaldehyd erfolgt in mehreren Schritten, hier wird nur die Gesamtreaktion angegeben: 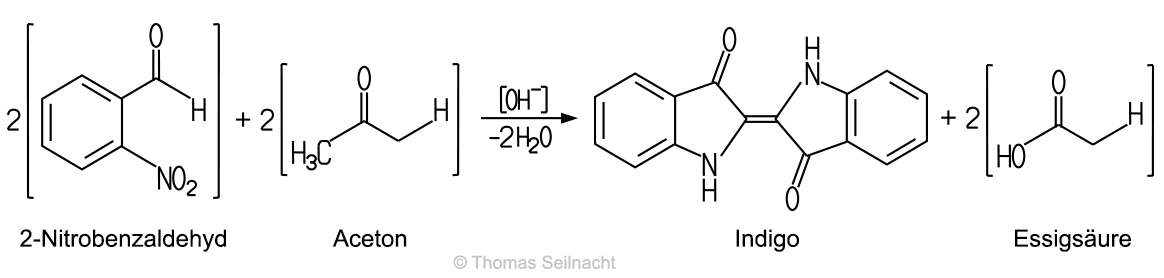 Baeyer erhielt 1905 als Auszeichnung für seine Farbstoffsynthesen den Nobelpreis für Chemie. Um 1890 gelang dem deutschen Chemiker Karl Heumann (1850–1894) in Zürich ein neues Syntheseverfahren, das er später noch verbesserte. Heumann verkaufte die Patente an die BASF und die Hoechst, die dann ab 1897 Indigo im großindustriellen Maßstab herstellen konnten. Bei der „Ersten Heumann-Synthese“ wird Anilin als Ausgangsstoff in einer Kondensationsreaktion zu Indoxyl umgewandelt. Dieses oxidiert man mit Sauerstoff in alkalischer Lösung zu Indigo. Bei der „Zweiten Heumann-Synthese“ sind Anthranilsäure und Chloressigsäure Ausgangsstoffe zur Indoxylherstellung. Aus diesen gewinnt man Phenylglycin-o-carbonsäure, die man in einer Natriumhydroxidschmelze zu 2-Indoxylcarbonsäure umwandelt. Die Carbonsäure gibt beim Erwärmen Kohlenstoffdioxid ab, und es entsteht das Indoxyl. Schon Anfang des 20. Jahrhunderts setzte sich ein Verfahren der Hoechst zur Herstellung aus Anilin und Ethylenoxid durch. Dabei entsteht Hydroxyethylanilin, das in einer heißen, alkalischen Schmelze aus Natriumhydroxid und Natriumamid ein Di-Anion bildet. Dieses cyclisiert beim schnellen Erhitzen und Abkühlen zum Indoxyl, das sich dann durch eine einfache Oxidation in Indigo umwandeln lässt: 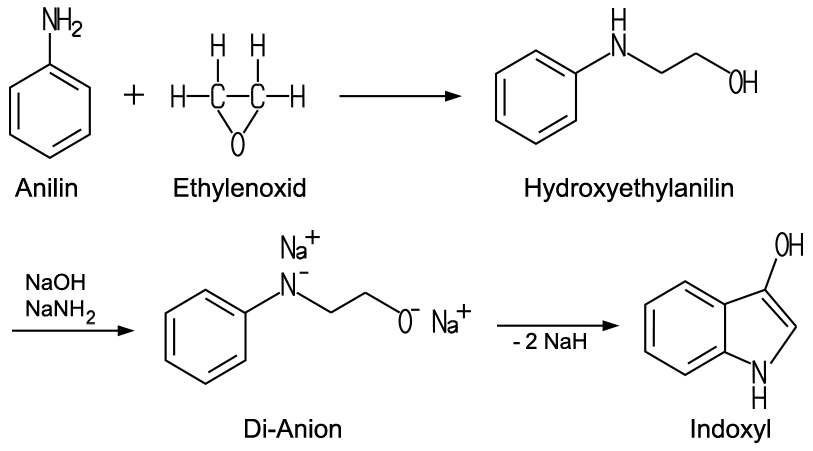 |
|
Verwendung
Indigo ist der bedeutendste
Farbstoff zum Färben
der von Levi Strauss im Jahr 1893 erfundenen
Jeans. Der Farbstoff zeichnet sich durch eine sehr gute Wasch- und
Lichtechtheit auf Baumwolle aus. Der Kattundruck war bis in die erste
Hälfte des 20. Jahrhunderts noch üblich: Dabei deckte man
bestimmte Stellen mit einer Reservepaste ab und färbte die
Baumwolltextilien danach mit Indigo. Dort, wo der Farbstoff nicht
durchdringen konnte, blieben die Textilien hell, so entstand eine
Struktur. Die Erzeugnisse waren zum Nähen von
Oberbekleidung für Frauen sehr beliebt. Eine relativ neue Anwendung
von Indigo ist der Einsatz als Halbleiter in
Solarzellen.
 Beim Färben der Seide in der Küpe bildet sich der blaue Indigo mit dem Luftsauerstoff erst nach dem Herausziehen. |