
|
Klare, ölige Flüssigkeit Vorkommen Etherische Öle, Steinkohleteer, Gärungen (Wiederkäuer) |
Molmasse
74,079 g/mol
AGW 10 ml/m3 (TRGS 900) pKs-Wert +4,87 Dichte 0,9882 g/cm3 Schmelzpunkt −20,5 °C Siedepunkt +141,5 °C Wasserlöslichkeit vollst. mischbar Explosionsgrz. 2,9 bis 12,1 Vol.-% (Luft) Flammpunkt +52 °C Zündpunkt +465 °C |
| Piktogramme
GHS 02 GHS 05 GHS 07 Gefahr |
Gefahrenklassen
+ Kategorie
Entzündbare Flüssigkeiten 3 Ätzwirkung auf die Haut 1B (Abstufung bei Verdünnungen) Spez. Zielorgantoxizität einmalig 3 |
HP-Sätze
(siehe auch Hinweis)
H 226, 314, 335 P 210, 260, 280.1-3, 303+361+353, 305+351+338 Entsorgung G 1 |
| Etikett drucken | Dt. Bezeichnung
Synonyme (deutsch) |
Engl. Bezeichnung
Synonyme (engl.) |
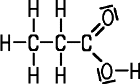
| CAS 79-09-4 | Propionsäure
Propansäure |
Propionic acid
Propanoic acid |
|
Bemerkungen
für Schulen: Propionsäure ist ein ätzender Stoff. Das
Tragen von Schutzbrille und Schutzhandschuhen ist vorgeschrieben. Es ist
auf eine gute Raumlüftung zu achten oder im Abzug zu arbeiten. Das
Arbeiten mit Propionsäure wird nur für erfahrene
Praktikumsteilnehmer empfohlen, da der Stoff penetrant riecht.
Eigenschaften Propionsäure riecht
unangenehm ranzig, die Dämpfe reizen die Augen und die Atemwege. Sie löst Wasser,
Ethylalkohol, Diethylether und Chloroform gut. Die Carbonsäure
ist im Vergleich zu Ameisensäure und Essigsäure
eine etwas schwächere Säure. Wie Essigsäure
wirkt Propionsäure keimtötend und eignet sich daher als Konservierungsstoff.
Eisen,
Zink, Magnesium
und andere unedle Metalle lösen sich unter Wasserstoffentwicklung
langsam auf. Dabei bilden sich die Salze der Propionsäure, die Propionate.
Mit Alkoholen können Ester
erzeugt werden. Für diese Reaktion ist Wärme und ein Katalysator
wie Schwefelsäure notwendig:
Propionsäure + Ethanol Das Produkt riecht rumartig
und wird als Aromastoff verwendet. Mit Pentanol erhält man einen apfelartig
riechenden Ester. Diese Ester sind
in geringen Mengen im Wein und im Latschenkieferöl enthalten. Mit
Cellulose entsteht Cellulosepropionat, ein hitzebeständiger und zäher
Kunststoff.
|
| Herstellung
Im Labor lässt sich Propionsäure durch eine Oxidation von 1-Propanol oder von
Propionaldehyd mit Kupferoxid herstellen. Propionsäure erhält
man in der chemischen Industrie durch die Reaktion von Ethen
mit Kohlenstoffmonooxid und Wasser in Gegenwart
von Nickelsalzen:
H2C=CH2 + CO + H2O |
| Verwendung
Propionsäure
dient zur Herstellung von Propionsäureestern
und Cellulosepropionat. Früher verwendete man sie als
Konservierungsstoff in Lebensmitteln und zur Synthese von
Schädlingsbekämpfungsmitteln.
|