|
|
|
Spektroskopische
Untersuchungsmethoden gehören zu den Standardverfahren der analytischen
Chemie. Dabei macht man sich die Eigenschaft zu Nutze, dass elektromagnetische
Strahlung je nach ihrer Energie eine Wechselwirkung mit Stoffen oder Molekülen
eingeht. Heute werden eine große Vielzahl an Verfahren eingesetzt.
Pionierarbeit leistete der deutsche Physiker und Optiker Joseph von Fraunhofer
(1787–1826).
Kurzwelliges Licht
wird im Prisma stärker gebrochen als langwelliges, daher kann zum Beispiel Sonnenlicht in seine Wellenanteile zerlegt werden. Fraunhofer untersuchte das
Sonnenlicht mit einem Prismen-Spektroskop. Der Physiker beobachtete im
Jahr 1814 dunkle Linien im Spektrum des Sonnenlichts. Der englische Chemiker
William Hyde Wollaston (1766–1828) hatte diese Linien schon 12 Jahre zuvor
entdeckt. Fraunhofer katalogisierte 570 Fraunhofer-Linien
und versah sie mit kleinen und großen Buchstaben. Allerdings konnte
er das Phänomen noch nicht erklären.
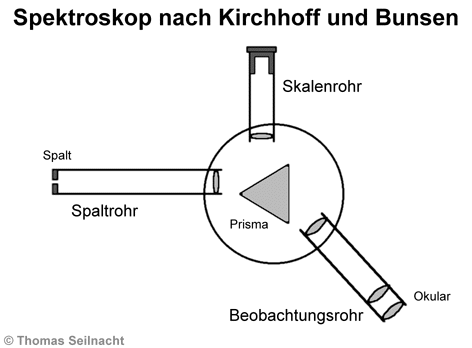
Gustav Robert Kirchhoff
(1824–1887) und Robert Wilhelm Bunsen (1811–1899) entwickelten ein wesentlich
genaueres Spektroskop. Das Licht fällt durch einen Spalt in das Spaltrohr
über eine Linse auf ein Prisma. Der Durchmesser des Spalts kann variiert
werden. Am Prisma werden die Wellenanteile des Lichts unterschiedlich gebrochen.
Sie gelangen in das verstellbare Beobachtungsrohr, wo durch ein optisches
System mit Linsen und Okular ein scharfes Bild erzeugt wird. Das durch
Kirchhoff und Bunsen entwickelte Skalenrohr projiziert eine Skala in den
Strahlengang, mit der die Wellenlängen ablesbar sind. Bei den später
entwickelten Taschenspektroskopen liegen das Spaltrohr und das Beobachtungsrohr
parallel. Dort wird das Licht durch ein mehrfaches Prismensystem zerlegt
und umgelenkt.
Kirchhoff und Bunsen
beobachteten, dass bestimmte chemische Elemente die Gasflammen eines Gasbrenners
färben. Sie konnten nachweisen, dass die von Fraunhofer beschriebenen
schwarzen D-Linien im Sonnenspektrum bei etwa 589 Nanometer mit der von
Natriumsalzen in der Flamme emittierten gelben Linie übereinstimmt.
Die beiden Chemiker entwickelten das erste spektralanalytische Verfahren.
Mit Hilfe dieses Verfahrens entdeckten sie die bis dahin unbekannten Elemente
Rubidium und Caesium.
Heute ist ein einfaches
Verfahren dieser Art in der Schule als Flammprobe
bekannt. Damit lassen sich die Atomsorten (der Elemente) bestimmen. Jedem
Element kann mit Hilfe der Flammenspektroskopie
ein typisches Linienspektrum zugeordnet werden. Die Flammenfarben
kann man mit bloßem Auge beobachten, die Linien lassen sich mit einem
Spektroskop beobachten, wenn man eine geringe Menge eines entsprechendes
Metall-Salzes mit Hilfe eines Edelstahl- oder Magnesiastäbchens in
eine rauschende Brennerflamme hält.
Hält man beispielsweise
mit Salzsäure angefeuchtetes Natriumchlorid in eine Brennerflamme,
verdampft zunächst das Wasser. Durch die Energie der Flamme werden
die Elektronen einzelner Natrium-Ionen angeregt und besetzen unter Aufnahme
von Energie ein höheres Energieniveau. Unter Aussendung von Licht
verlassen die Elektronen wieder den angeregten Zustand. Im Spektroskop
erscheint beim Natrium eine typische, gelborange Doppellinie bei 589 nm
(einfache Spektroskope zeigen nur eine Linie, da sie die beiden Linien
nicht auflösen können). Das Befeuchten mit Salzsäure oder
die Zugabe von Ammoniumchlorid führt zur Entstehung von Chlor; dieses
verhindert, dass die Salze in der Flamme zu Oxiden oxidieren, die nur schwer
anregbar sind.
Bei einem Emissionsspektrum
wird elektromagnetische Strahlung in farbigen Linien dargestellt, die von
Atomen ausgesendet wird, wenn Elektronen ihren angeregten Zustand aufgeben.
Dies ist bei den Flammenfarben der Fall oder wenn eine Natriumdampflampe
leuchtet. Strahlt man dagegen Licht durch Natriumdampf, dann
erscheinen in einem gut auflösenden Spektroskop bei etwa 589 Nanometer
die typischen schwarzen Doppellinien. Bei einem Absorptionsspektrum
erscheinen dunkle Linien vor dem kontinuierlichen sichtbaren Spektrum.
Die Linien stellen die Wellenlängen der elektromagnetischen Strahlung
dar, die von den Natrium-Atomen aus Licht absorbiert werden.
Die Fraunhoferlinien im kontinuierlichen Spektrum der Sonne entstehen dadurch,
dass bestimmte Elemente in der oberen Sonnenatmosphäre vorkommen,
die bestimmte Wellenanteile aus dem Licht absorbieren. Aber auch die Wolken
und die Atmosphäre der Erde absorbieren Anteile des Sonnenlichts.
Moderne Messgeräte
zur Atomemissionsspektrometrie (AES)
messen mit einem Photodetektor die exakte Wellenlänge der zugeordneten
Emissionslinien. Stoffproben, bzw. die zu nachweisenden Atome lassen sich
mit allen Methoden anregen, die viel Energie erzeugen. Es eignen sich Lichtbogen,
Laserlicht, Röntgenstrahlung oder sogar Plasma. Ein Photodetektor
misst dann die exakte Wellenlänge des emittierten Spektrums.
Bei der Atomabsorptionsspektrometrie (AAS)
wird die zu untersuchende Stoffprobe zerstäubt, in einer Flamme verdampft
und in einen Lichtstrahl aus einer Hohlkathodenlampe gehalten. Die Lampe
enthält einen Quarzkolben, der mit dem gesuchten Element gefüllt
ist. Der Photodetektor misst das auftretende Linienspektrum mit und ohne
Probe. Wird das Spektrum der Lampe vollständig absorbiert, handelt
es sich um das gesuchte Element.
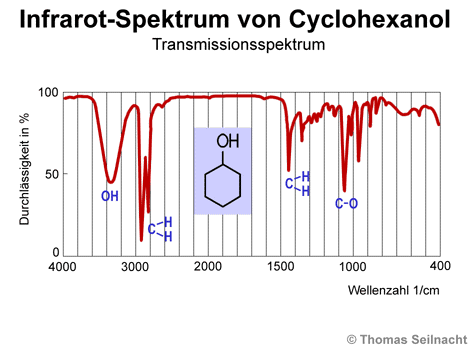
Bei der Flammenspektroskopie werden Energiezustände in Atomen gemessen. Die Infrarotspektroskopie ist ein Beispiel für eine Analysemethode, die Energiezustände in Molekülen oder Molekülgruppen misst. Das langwellige Infrarotlicht ist für das menschliche Auge nicht sichtbar. Gemessen wird neben der Absorption auch die Transmission, die Durchlässigkeit der Moleküle für Infrarotlicht. Eine Stoffprobe wird in einer Küvette mit Infrarotlicht (IR-Strahlung) durchstrahlt. Bestimmte Frequenzen der IR-Strahlung werden durchgelassen, einige absorbiert. Der Monochromator zerlegt die IR-Strahlung, der Detektor misst das auftretende Spektrum. Man erhält über den Verstärker und die Auswertungseinheit eine Kurve, die anzeigt, bei welchen Wellenzahlen (Kehrwert der Wellenlänge) eine Absorption stattgefunden hat. Das dargestellte IR-Spektrum
zeigt das Ergebnis bei der Durchstrahlung von Cyclohexanol. Typische „Knicke“ der Kurven lassen sich bestimmten Verknüpfungen oder funktionellen
Gruppen im Cyclohexanol-Molekül zuordnen. So kann man beispielsweise
ablesen, ob das Molekül OH-Gruppen oder eine C-O-Verbindung enthält.
Ein Spektralphotometer ermittelt, bei welcher Wellenlänge ein Farbstoff oder ein Pigment UV-Licht und sichtbares Licht absorbiert. Das Verfahren ist in der chemischen Analyse weit verbreitet, beispielsweise zur Bestimmung von Färbungen bei Fällungsreaktionen oder bei der Messung von Verunreinigungen im Wasser. Zur Vorbereitung einer spektralphotometrischen Untersuchung von Blattfarbstoffen wird ein herbstliches, gelbes Ahornblatt zunächst zerkleinert und in Aceton gelöst. Mit niedrig siedendem Benzin werden die Farbstoffe extrahiert und auf die Startlinie einer Dünnschichtplatte aufgetragen. Das Fließmittel (Benzin + Isopropylalkohol) transportiert die Farbstoffe auf der Platte. Man erhält ein Chromatogramm mit den aufgetrennten Phasen der enthaltenen Farbstoffe: Zur Bestimmung einer
Farbstoffkomponente kratzt man sie von der Platte, löst sie in reinem
Ethanol und gibt diese Lösung in eine Küvette. Sendet man in
einem Spektralphotometer weißes Licht durch die Küvette, lässt
sich mit Hilfe des Monochromators und der Messeinheit ermitteln, bei welcher
Wellenlänge eine Absorption in der Farbstoff-Lösung stattfindet.
Ein Absorptionsmaximum von etwa 440nm in der ethanolischen Lösung
der 4. Phase weist auf den Farbstoff Lutein hin. Dieser gehört wie
das Violaxanthin und das Neoxanthin zu den Xanthophyllen, die bei der Fotosynthese
die Aufgabe innehaben, die Lichtenergie aufzufangen und zu den Chlorophyllen
zu leiten.
Im Herbst produziert
der Ahorn mehr Xanthophylle, um die Energiegewinnung bei verringerter Strahlung
zu gewährleisten. Aus diesem Grunde werden die Blätter im Herbst
an den Laubbäumen gelb. Können die absterbenden Blätter
den Sauerstoff nicht mehr verarbeiten, oxidieren die gelben Farbstoffe
und die Blätter werden rot.
Hinweis: Bei der Massenspektroskopie werden die Massen von Atomen, Molekülen oder Ionen bestimmt. Sie gehört nicht zu den spektroskopischen Verfahren, die elektromagnetische Strahlung messen. |
| Weitere
Materialien
Schülerübung Flammenfärbung Virtuelle Analyse |
| Literatur
Asselborn, Wolfgang, u.a. (Hg.): Chemie heute, Sekundarbereich II, S. 224ff., Hannover 1998 Glöckner/Jansen/Weissenhorn (Hg.): Handbuch der experimentellen Chemie, Sekundarbereich II, Band 3/II Analytische Chemie II, S. 2-4, Leipzig 2011 Konrad, Ulf: Prismenspektroskop, www.ulfkonrad.de Kremer/Bannwarth: Einführung in die Laborpraxis, Berlin/Heidelberg 2009 Leitner, Ernst und Finckh, Uli: Leifi Physik, Natriumabsorptions- und Emissionslinie, Ratsgymnasium Rotenburg, www.leifiphysik.de Bayrhuber/Kull/Lindner: Biologie, Braunschweig 2005 Loibl, Bernd: Beispiele für Selbstbauspektroskope, www.bernd-loibl.de/spectra.html Schmuck/Engels, u.a.: Chemie für Mediziner, S. 26ff., München 2008 Seilnacht, Thomas: Praktikumsbericht zum Seminar Organische Chemie und Biochemie im Hauptseminar von H. Daumke, Pädagogische Hochschule Freiburg 1988 Strohmann, Carsten: Beiträge zur Spektroskopie, www-anorganik.chemie.uni-wuerzburg.de/strohmann/lehre/download/a1_9.pdf Winklmair, Dieter: Versuch: Atom-Absorptions-Spektrometrie, www.winklmair.de Beiträge auf Wikipedia: Fraunhoferlinie und Spektroskopie, de.wikipedia.org |