|
Nur für Lehrkräfte geeignet
Inhalt
Didaktische Bemerkungen Demonstration 1 Ein Wasserstoffballon wird entzündet Demonstration 2 Eine Gasflamme wird entzündet Demonstration 3 Experimente mit Knallerbsen Demonstration 4 Chlorknallgas – Licht als Energieträger Literatur
Bei den Sulfid-Reaktionen
zeigte sich schon, dass zum Einleiten einer chemischen
Reaktion zunächst Energie zugeführt werden muss. Das Eisen-Schwefelgemisch
ließ sich mit einem brennenden Span zünden, das Zink-Schwefel-Gemisch
mit einer glühenden Stricknadel. Bei der folgenden Versuchsreihe soll
gezeigt werden, dass es verschiedene Möglichkeiten gibt, Stoffe mit
Aktivierungsenergie zu einer Reaktion
zu veranlassen.
Demonstration
1 Ein Wasserstoffballon wird entzündet
GBU Deutschland für das Arbeiten mit Wasserstoff docx pdf SB Schweiz für das Arbeiten mit Wasserstoff docx pdf
Ein
Luftballon wird mit Wasserstoff gefüllt und an einer Schnur befestigt.
Mit einem langen, brennenden Span nähert man sich vorsichtig dem Ballon.
Kopf fernhalten! Schutzbrille und Schutzhandschuhe aus Leder tragen! Auf Brandschutz im Raum achten! Der Ballon zerplatzt, und der Wasserstoff verbrennt in
einem Feuerball. Dieser Versuch zum Einstieg wurde ganz bewusst
gewählt. Der brennende Span zerstört die Außenhaut des
Systems Gasballon. Dieser Vorgang symbolisiert die Zerstörung eines
stabilen Systems. Die Flamme aktiviert die chemische Reaktion, das Verbrennen
des Wasserstoffs.
Lässt man aus einem
Brenner wenig Butangas oder aus einer Wasserstoffflasche über eine Düse
(mit Rückschlagsicherung) wenig Wasserstoff ausströmen, entzündet
sich das Gas zunächst nicht. Die Schüler machen den Vorschlag,
die Gasflamme mit einem Streichholz zu entzünden. Bei der Frage nach
weiteren Möglichkeiten wird es schon schwieriger. Man kann probieren,
ob sich die Flamme mit einem glühenden Draht oder mit einem elektrischen
Zündfunken entzünden lässt. In allen Fällen ist die
Zufuhr von Energie notwendig. Beim Feuerzeug wird das Gas entweder durch
ein piezokeramisches Zündelement elektrisch oder durch das Reiben
eines Cer-Eisen-haltigen Zündsteines an einer rauen Oberfläche
entzündet. Nach letzterem Prinzip funktionieren auch die alten Gasanzünder:
Eine Knallerbse aus dem
Spielzeugbedarf wird etwa 10 Zentimeter über den Boden gehalten und fallengelassen.
Danach tut die Lehrkraft so, als ob die Knallerbse nicht funktioniert.
Die Schülerinnen und Schüler werden sofort vorschlagen, die Knallerbse von weiter oben
fallen zu lassen. Auch hier wird zu dem berührungsempfindlichen Sprengstoff
in der Knallerbse Energie zugeführt. Sie entsteht durch das Fallen
der Knallerbse aufgrund der Schwerkraft und durch die Kollision mit dem
Boden, wobei die Energie beim Aufprall in das System der Knallerbse abgeleitet
wird. Nun kann man weitere Möglichkeiten probieren, die Knallerbse
zur Explosion zu bringen:
Man kann auch versuchen,
eine Knallerbse zu öffnen und den Sprengstoff isolieren (Schutzbrille
tragen!). Hierbei explodiert der Sprengstoff eventuell schon durch Reibung.
Bei diesen Experimenten zeigt sich, dass nicht jede Energiemenge die Knallerbse
zur Explosion bringt. Es ist ein bestimmter Energiebetrag notwendig, damit
die chemische Reaktion eingeleitet wird.
Diese
Demonstration wird für Schulen nicht empfohlen, stattdessen kann ein
Film eingesetzt werden. Bei einer Durchführung müssen
alle Sicherheitsbestimmungen beim Arbeiten mit Chlor
und mit konzentrierter Salzsäure
eingehalten werden:
Sind diese Bestimmungen nicht
gewährleistet, muss dringend von einer Durchführung der Demonstration
abgeraten werden!
Die Herstellung von Chlorgas erfolgt in einem Gasentwickler. Ein Reagenzglas (20x180 mm) wird pneumatisch zur Hälfte mit Chlor gefüllt: Dazu legt man das Reagenzglas an den Boden einer mit Wasser gefüllten Schale, so dass es ganz voll mit Wasser ist, dreht es mit der Öffnung nach unten um und leitet das Chlor ein. Dann füllt man die zweite Hälfte mit Wasserstoff aus der Gasflasche und setzt einen Stopfen auf. Dabei ist zu beachten, dass sich in der Schlauchzuleitung von der Gasflasche keine Luft mehr befindet. Durch Mischbewegungen werden die beiden Gase vermischt. Das Reagenzglas wird an eine dunkle Stelle gelegt und mit einem Tuch bedeckt. 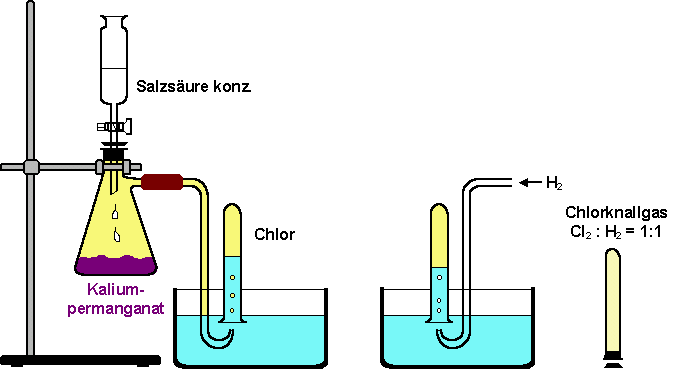
Ein Elektronenblitzgerät
wird scharf gemacht und bereit gelegt. Dann dunkelt man den Raum noch mehr
ab und stellt das vorbereitete Reagenzglas in den Abzug direkt hinter die
Schutzscheibe. Das Anblitzen des Gemisches aus einem Meter Entfernung verursacht
normalerweise keine Reaktion. Dann nähert man sich mit dem Blitz bis
auf 10 Zentimeter. Alternativ kann über das Reagenzglas auch eine große
Glocke aus Kunststoff oder besser noch eine umgedrehte Plexiglaswanne gestülpt
werden. Ergänzend kann auch im Film gezeigt werden, dass eine Wasserstoffflamme
in Chlorgas völlig ruhig brennt.
Beobachtung:
Ist die Blitzenergie groß genug, explodiert
das Chlorknallgas in dem Reagenzglas mit einem Knall, wobei das Glas zerfetzt
wird. Beim Zünden des Gemisches in der Glocke beschlägt sich
die Wand des Behälters von innen.
Theorie: Chlor und Wasserstoff explodieren bei optimaler Mischung (1 zu 1) heftig, wobei gasförmiger Chlorwasserstoff entsteht:
H2 +
Cl2
Diese Reaktion ist stark
exotherm. Die entstehende Temperatur beträgt bis zu 2000 °C. Licht,
vor allem hochenergetisches Licht wie UV-Licht, spaltet Chlormoleküle
in zwei Chlor-Radikale:
Cl2
Diese
Chlorradikale sind fähig, das Wasserstoffmolekül ebenfalls in
Radikale aufzuspalten, es kommt zu einer Kettenreaktion:
Cl·
+ H2
H· + Cl2
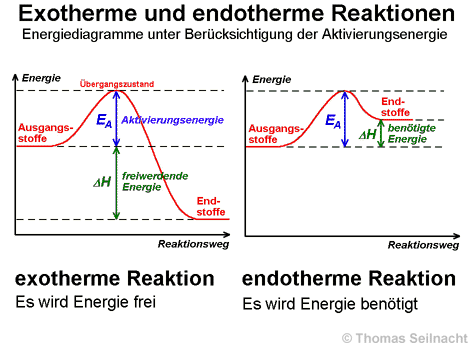
Das
Beispiel verdeutlicht, wie durch Aktivierungsenergie Übergangszustände
und neu geordnete Systeme erreicht werden, so dass die Reaktion von selbst
ablaufen kann.
Variationen: Die Zündung des Chlor-Knallgases kann unter Einhaltung der Sicherheitsvorschriften auch mit Tageslicht, mit einer starken Lampe oder durch Einblasen von Magnesiumpulver in eine Brennerflamme erfolgen. Allerdings ist dabei viel Fingerspitzengefühl notwendig. Robert Wilhelm Bunsen beschrieb diesen Versuch in einem Brief an Sir Henry Enfield Roscoe. Die Nachahmung sei nur geübten und sicheren Experimentatoren überlassen: „Ich freue mich herzlich, mein teuerster Freund, dass Sie zeitig im Frühling herüberkommen wollen, damit wir unsere Arbeit zum Abschluss bringen können. Ich habe in diesen Tagen den photochemischen Vorlesungsversuch, von dem wir hier sprachen, ausgeführt, und hoffe mit Hülfe desselben noch einige recht interessante Daten für unsere Untersuchung zu gewinnen. Der Versuch gelingt auf folgende Weise am besten:
Man leitet die in
unserem Wasserstoff-Chlor-Entwicklungsapparat erzeugte Gasmenge im Dunkeln
durch das System von Glaskugeln B, die ungefähr die Größe
eines Taubeney's haben und so dünn geblasen sind, dass sie sich
mit dem Finger zerdrücken lassen und die vor dem Durchleiten stark
mit Wasser inwendig benetzt sind. Ist der Apparat gefüllt, so schnürt
man die Kautschukligaturen in geschmolzenes gelbes Wachs. Hält man
eine solche Kugel, die sich mehrere Tage ohne zu verderben aufbewahren
lässt, in die Nähe eines offenen Fensters, so explodiert
sie momentan. Man kann die Kugel dabei ganz gefahrlos an ihrem Stiel mit
der Hand halten, wenn man einen Handschuh anzieht und zwischen die Kugel
und das Gesicht eine kleine Glasplatte hält. Die Explosion erfolgt
an den trübsten Tagen selbst bei ziemlich dichtem Nebel und ist kaum
gefährlicher, als die Entzündung einer mit O, H gefüllten
Seifenblase. Ich habe nun in dem Fenster des Auditoriums eine rote und
eine blaue Fensterscheibe einsetzen lassen: hält man die Kugel hinter
die erstere, so bleibt sie unverändert, während sie vor die letztere
gebracht augenblicklich explodiert. Es gibt kaum einen Vorlesungsversuch,
der schöner wäre als dieser...“
Ausblick: Die thematische Behandlung der Katalyse schließt sich an. Katalysatoren sind Stoffe, die das Erreichen dieser Übergangszustände in besonderem Maße begünstigen.
|