Der französische Physiker Alexandre Edmond Becquerel (1820–1891) entdeckte im Jahr 1839 den photoelektrischen Effekt: In einem Topf trennte er zwei elektrisch leitende Lösungen durch eine Membran. Die Oberseite des Topfes versah er mit Klappen, so dass man die beiden Seiten abdunkeln konnte. Becquerel stellt in jede Flüssigkeit Platten aus Platin und öffnete den Deckel einer Seite. Mit einem Galvanometer konnte er einen Unterschied des elektrischen Potenzials zwischen den beiden Flüssigkeiten messen, sobald Licht nur auf einer Seite der Membran in die Lösung auftraf. Im Vergleich zu Becquerels Experiment verwenden moderne Solarzellen keine chemischen Lösungen, sondern sie nutzen den Sperrschicht-Effekt, der sich beim Aneinanderlegen von verschieden dotierten Halbleitermaterialien aufbaut. Als Phänomen tritt beim Auftreffen von Licht auf die Halbleiterschichten der photovoltaische Effekt auf, hierbei wird Lichtenergie in elektrische Energie umgewandelt.
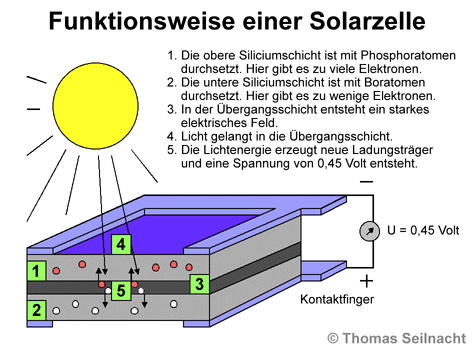
Zur Herstellung von Solarzellen
wird hochreines, kristallines Silicium benötigt
(>Vom Quarz zum Mikrochip). Zum Dotieren
des Siliciums mit Fremdatomen werden die Phosphor-
oder Bor-Atome mit Trägergasen wie Sauerstoff
oder Stickstoff versetzt. Das Gemisch lässt man über die Waferscheiben
aus Silicium strömen. Licht wird auf reinem Silicium relativ gut reflektiert;
um diesen negativen Effekt zu vermeiden, wird eine dünne Siliciumnitrid-Schicht
(Si3N4) aufgedampft. Diese setzt das Reflexionsvermögen
des Siliciums stark herab, sie erzeugt auch die für Solarzellen typische,
blaue Farbe. Werden mehrere Solarzellen miteinander verbunden, erhält
man ein Solarmodul. So lassen sich Module mit verschiedener Spannung und
Leistung herstellen. Durch Reihenschaltungen addieren sich die Spannungen,
durch Parallelschaltungen erhält man eine höhere Stromstärke.
Bei Solarzellen mit amorphem
Silicium wird das Silicium zusammen mit den Dotierungsstoffen auf eine
mit Zinnoxid beschichtete Glasplatte in dünnen Schichten aufgedampft.
Die Dünnschicht-Solarzellen benötigen erheblich weniger Silicium
als Rohstoff, da die Schicht nur etwa 500 Nanometer dick ist (1 Milliarde Nanometer
= 1 Meter). Ein weiterer Vorteil ist darin zu sehen, dass diese Solarzellen
extrem dünn oder sogar flexibel gebaut werden können. Solarzellen
mit Cadmiumtellurid (CdTe), Cadmiumsulfid (CdS) oder Kupfer-Indium-Sulfid
(CIS) lassen sich ebenfalls in sehr dünnen Schichten herstellen. Der
Nachteil der Dünnschicht-Solarzellen besteht in ihrem relativ schlechten
Wirkungsgrad. So erreicht eine Cadmiumtellurid-Solarzelle in Serienproduktion
nur etwa 12% Wirkungsgrad, während bei Solarzellen mit monokristallinem
Silicium bis zu 22 % erreicht werden können [Lit
Quaschnig 2009].
Farbstoffsolarzellen nach Michael Grätzel
Der deutsch-schweizerische
Chemiker Michael Grätzel (geb. 1944) entwickelte in den 1990er Jahren
eine Solarzelle, die kein Silicium benötigt, sondern organische Farbstoffe
zur Absorption von Licht verwendet. Diese auch als Grätzelzelle bekannte
Solarzelle wurde im Jahr 1992 patentiert. Ihr Vorteil liegt vor allem darin,
dass der aufwändig zu produzierende Rohstoff Silicium nicht mehr benötigt
wird und die Schichten extrem dünn aufgetragen werden können.
Die ersten Farbstoffsolarzellen erreichten allerdings nur einen Wirkungsgrad
von weniger als 10 %. Durch die Verwendung von elektrisch leitfähigen
Polymeren wie Polypyrrol (statt TCO-Glas) können Wirkungsgrade von
mehr als 30 % erreicht werden. Ein weiteres technisches Problem stellt die
Versiegelung der Zelle dar, damit der Elektrolyt sicher eingeschlossen
wird. Betriebe, die darauf spezialisiert sind, bieten Klebstoffe wie Epoxydharzkleber
oder Glaslote an.
die mit einem Farbstoff eingefärbt ist. Die gegenüberliegende TCO-Platte ist
mit Graphit beschichtet. Dazwischen befindet sich eine Elektrolyt-Lösung.
Eine für die Schule geeignete Grätzelzelle kann so aufgebaut werden: Die obere Glasplatte, auf die das Licht trifft, ist auf der Unterseite mit einer hauchdünnen, transparenten, elektrisch leitfähigen Schicht versehen. Hierfür eignet sich fluor-dotiertes Zinnoxid. Die so vorbehandelten Glasplatten sind im Handel unter dem Namen TCO-Glas erhältlich (transparent conducting oxide). Auf diese Schicht wird eine weitere, etwa 10 Mikrometer dünne Schicht nanokristallines Titandioxid (TiO2) aufgetragen. Dieses färbt man nach dem Brennen in einem Ofen oder auf einer Keramikheizplatte mit einem organischen Farbstoff ein. Für das Schullabor eignen sich Farbstoffe von Fruchtsäften (Brombeeren, Kirschen, Heidelbeeren), Tee (Hibiskustee) oder sogar Rotwein. Die untere Glasplatte besteht ebenfalls aus TCO-Glas. Sie wird mit einem weichen Bleistift bemalt, so dass man eine hauchdünne, leitfähige Graphitschicht erhält (in der Industrie wird auch Platin eingesetzt). Dann werden die TCO-Platten gegeneinander gelegt, nachdem ein paar Tropfen eines Elektrolyten darauf gegeben worden sind.
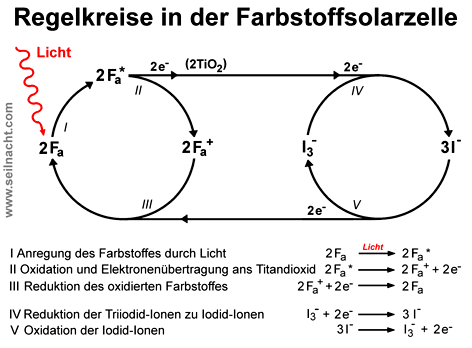
In einer Farbstoffsolarzelle werden die Elektronen von Farbstoffmolekülen Fa durch Licht in einen angeregten Zustand versetzt (I). Die so angeregten Farbstoffmoleküle Fa* geben beim Kontakt mit Titandioxid Elektronen in die leitfähige Schicht ab und gehen in einen oxidierten Zustand Fa+ über (II). An der Anode (Minuspol) tritt ein Überschuss an Elektronen auf. Über den Verbraucher werden die Elektronen an der Kathode (Pluspol) wieder in das System eingeführt. Die Triiodid-Ionen im Elektrolyt nehmen die Elektronen auf und werden zu Iodid-Ionen reduziert (IV). Da der Elektrolyt Kontakt zu oxidierten Farbstoffmolekülen hat, kann er an diese Elektronen abgegeben (V), dabei werden die Iodid-Ionen wieder zu Triiodid-Ionen oxidiert. Die oxidierten Farbstoffmoleküle werden bei der Elektronenaufnahme reduziert, so dass der Farbstoff in seine ursprüngliche Form geht (III). Der „Motor“ für das Ablaufen der Reaktionen in den Regelkreisen sind die Lichtquanten, die auf das System kontinuierlich einwirken.
Weitere Informationen
Experiment: Farbstoffsolarzellen selbst bauen
Experiment: Grundversuche zur Photovoltaik
Einführung: Die Nutzung erneuerbarer Energien
Silicium im Periodensystem
Diashow: Vom Quarz zum Mikrochip
Literaturquellen
Literaturverzeichnis