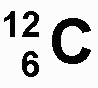zum Periodensystem
Erläuterungen
zum Periodensystem
von Thomas Seilnacht
Die folgenden Erläuterungen
sollen mit Hilfe der drei elementaren chemischen Grundbegriffe "Stoff",
"Element" und "Atom" den Aufbau des Periodensystem unter drei verschiedenen
Gesichtspunkten darstellen und erklären. Innerhalb der Erläuterungen
werden weitere gebräuchliche chemische Fachbegriffe erörtert.
1.
Der Stoffbegriff im Hinblick auf das Periodensystem
Das Wasser kennen wir als
Eis, Wasser oder Wasserdampf. Im reinen chemischen Sinne handelt es sich
um ein oder denselben Stoff, da bei
der Zufuhr von Wärme, wenn Eis schmilzt, keine Umwandlung im Grundaufbau
des Stoffes stattfindet. Jedoch besitzt Eis physikalisch gesehen eine niedrigere
Dichte als Wasser und unterscheidet sich damit wesentlich. Ob es sich um
ein oder denselben Stoff handelt, ist somit reine Definitionssache. Wenn
ein "normaler Bürger" von dem Stoff "Eis" spricht, meint er den Stoff
wie er ihn leibhaftig vor sich sieht oder spürt, für ihn existieren
vom Wasser durchaus verschiedene Stoffbegriffe. Die Eskimos beispielsweise
kennen für das Wort Eis mindestens 10 verschiedene Wörter! Dieses
Beispiel zeigt, dass Begriffe niemals als endgültig und absolut gesehen
werden dürfen. |
 Eiskristalle an einem
Fenster
Eiskristalle an einem
Fenster
|
Der bisherige, traditionelle
Stoffbegriff der Chemie versuchte,
in der Natur elementare Gesetzmäßigkeiten zu finden und sie
mit Modellen zu erklären. Der chemische Stoffbegriff ist ein Kunstbegriff,
der nicht den leibhaftigen Stoff meint, sondern anhand des Begriffes bestimmte
Grundeigenschaften von beispielsweise Wasser herleiten möchte. Das
Periodensystem ist ein Werkzeug zur Sortierung und Übersicht über
eine Vielzahl derartiger Ableitungen. Es ist so angelegt, dass Elemente
mit stofflich ähnlichen Eigenschaften in Gruppen aufgeteilt sind.
In der Hauptgruppe I stehen alle Alkalimetalle
untereinander, wobei Wasserstoff nicht zu diesen Metallen zählt. Alle
Elemente der Gruppe (Lithium, Natrium, Kalium, Rubidium, Cäsium) besitzen
metallische Eigenschaften wie Stromleitfähigkeit oder Glanz und reagieren
mehr oder weniger heftig mit Wasser und Luft. Die Elemente der Hauptgruppe
VII - die Halogene Fluor, Chlor,
Brom und Iod - zeichnen sich ebenfalls durch große Reaktionsfähigkeit
und Aggressivität aus. Dagegen reagieren die Elemente der VIII. Hauptgruppe
(Edelgase Helium, Neon, Argon, Krypton,
Xenon, Radon) kaum mit anderen Stoffen, sie gelten als sehr reaktionsträge.
Übersicht
an Elementgruppen im Periodensystem
a) Hauptgruppenelemente
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
|
H
|
|
|
|
|
|
|
He
|
|
Li
|
Be
|
B
|
C
|
N
|
O
|
F
|
Ne
|
|
Na
|
Mg
|
Al
|
Si
|
P
|
S
|
Cl
|
Ar
|
|
K
|
Ca
|
Ga
|
Ge
|
As
|
Se
|
Br
|
Kr
|
|
Rb
|
Sr
|
In
|
Sn
|
Sb
|
Te
|
I
|
Xe
|
|
Cs
|
Ba
|
Tl
|
Pb
|
Bi
|
Po
|
At
|
Rn
|
|
Fr
|
Ra
|
|
Uuq
|
|
Uuh
|
|
Uuo
|
I.
Hauptgruppe (Alkalimetalle, Ausnahme: H gehört nicht dazu!)
Lithium,
Natrium, Kalium, ...
weiche Metalle, heftige Reaktion mit Wasser oder Luft
II.
Hauptgruppe (Erdalkalimetalle)
Beryllium,
Magnesium, Calcium,... langsame Reaktion mit Wasser oder Luft
VII.
Hauptgruppe (Halogene)
Fluor,
Chlor, Brom, Iod
aggressive, reaktionsfähige Elemente
VIII.
Hauptgruppe (Edelgase)
Helium,
Neon, Argon, ...
sehr reaktionsträge Gase
b) Nebengruppenelemente
|
Sc
|
Ti
|
V
|
Cr
|
Mn
|
Fe
|
Co
|
Ni
|
Cu
|
Zn
|
|
Y
|
Zr
|
Nb
|
Mo
|
Tc
|
Ru
|
Rh
|
Pd
|
Ag
|
Cd
|
|
6
|
Hf
|
Ta
|
W
|
Re
|
Os
|
Ir
|
Pt
|
Au
|
Hg
|
|
7
|
Rf
|
Db
|
Sg
|
Bh
|
Hs
|
Mt
|
Uun
|
Uuu
|
Uub
|
|
6
|
La
|
Ce |
Pr
|
Nd
|
Pm
|
Sm
|
Eu
|
Gd
|
Tb
|
Dy
|
Ho
|
Er
|
Tm
|
Yb
|
Lu
|
Lanthanoide
|
|
7
|
Ac
|
Th
|
Pa
|
U
|
Np
|
Pu
|
Am
|
Cm
|
Bk
|
Cf
|
Es
|
Fm
|
Md
|
No
|
Lr
|
Actinoide
|
Lanthanoide
(Nr. 57 bis 71)
Alle
Elemente sind dem Element Nr. 57 (Lanthan,
La) sehr ähnlich: silberweiße, reaktionsfähige Metalle,
die an feuchter Luft oxidieren und mit Wasser oder verdünnten Mineralsäuren
unter Wasserstoffentwicklung reagieren. Viele Lanthanoide sind im fein
verteilten Zustand pyrophor, d.h. sie entzünden sich von selbst. Alle
Lanthanoide sind sehr unedel, wobei das Lutetium
(Lu) das am wenigsten unedle ist.
Actinoide
(Nr. 89 bis 103)
Alle
Elemente sind dem Element Nr. 89 (Actinium,
Ac), aber auch dem Lanthan sehr ähnlich:
silberweiße, reaktionsfähige Metalle
2. Der Elementbegriff
im Hinblick auf das Periodensystem
Das Periodensystem,
wie wir es heute kennen, listet 118 verschiedene Stoffe auf, die im Vergleich
zu den anderen Hunderttausenden von Stoffen, die heute bekannt sind oder
künstlich hergestellt wurden, eine besondere Gemeinsamkeit haben.
So grundverschieden wie sie sich in ihren äußerlichen Eigenschaften
teilweise unterscheiden, so lassen sich alle auf etwas "Elementares" zurückführen.
Dass in der Natur aus einem
Stoff ein anderer werden kann, ist dem Menschen erst nach und nach bewusst
geworden. Der menschliche Körper ist ein riesiges und von der
Natur genial ausgedachtes Umwandlungssystem von tausenden von Stoffen.
Aus Sauerstoff und Kohlenhydraten entsteht unter Energieerzeugung Kohlendioxid
und Wasser, welches die Pflanzen in der Fotosynthese wieder "zurückverwandeln"
und das Kreislaufsystem vervollständigen. |
 Gold und Gangquarz
aus Australien
Gold und Gangquarz
aus Australien
|
Etwas nüchterner stellt
sich ein solcher Umwandlungsprozess im chemischen Labor dar: Ein Stoff
wie Wasser ("chemische Verbindung") lässt sich auf chemischem Wege
in zwei Stoffe, nämlich zu den Elementen Wasserstoff und Sauerstoff
umwandeln. Man sagt auch "Wasser reagiert zu Wasserstoff und Sauerstoff".
Diese Produkte können chemisch nicht mehr weiter "aufgespalten"
werden, um einen weiteren Stoff im chemischen Sinne zu erhalten, es sei
denn man zerstört ihre Systemstruktur und erhält die kleineren
Aufbausteine, aus denen sie zusammengestzt sind, aber dann geraten wir
in die Begriffswelt der Atome. Um sie in andere Stoffe umzuwandeln,
sind immer weitere Reaktionspartner notwendig. Das Element Wasserstoff
benötigt beispielsweise Sauerstoff oder Stickstoff, um einen neuen
Stoff bilden zu können. Ein chemisches Element
ist im chemischen Sinne ein Stoff, der ohne einen Reaktionspartner nicht
mehr umwandlungsfähig ist. Die 118 chemischen Elemente sind elementares
"Baumaterial" zur Herstellung sämtlicher Stoffe, die wir heute kennen.
Interessanterweise kommen die meisten Elemente in der Natur nur sehr selten
elementar vor, sondern meistens ihre Bauprodukte, die chemischen
Verbindungen (vgl.
die Mineraliengalerie).
Damit das Periodensystem
international verständlich ist, werden die Elementbezeichnungen in
chemischen Symbolen angegeben. Die Symbole
und Namen leiten sich von griechischen und lateinischen Wörtern ab:
|
Nr
|
Symbol
|
deutscher Name
|
englischer Name
|
Bedeutung/Herkunft
|
|
1
|
H
|
Wasserstoff
|
hydrogen
|
hydrogenium (lat. "Wasserbildner")
|
|
2
|
He
|
Helium
|
helium
|
helios (griech. "die
Sonne")
|
|
3
|
Li
|
Lithium
|
lithium
|
lithos (griech. "der
Stein")
|
|
4
|
Be
|
Beryllium
|
beryllium
|
nach dem Edelstein Beryll
|
|
5
|
B
|
Bor
|
boron
|
boron (lat.)
|
|
6
|
C
|
Kohlenstoff
|
carbon
|
carbo (lat. "Kohle")
|
|
7
|
N
|
Stickstoff
|
nitrogen
|
nitrogenium (lat. "Salpeterbildner")
|
|
8
|
O
|
Sauerstoff
|
oxygen
|
oxygenium (lat. "Säurebildner")
|
|
9
|
F
|
Fluor
|
fluorine
|
fluere (lat "fließen")
|
|
10
|
Ne
|
Neon
|
neon
|
neos (gr. "neu")
|
3. Der Atombegriff
im Hinblick auf das Periodensystem
Im Menschen sind durchschnittlich
folgende Stoffe enthalten:
40 Liter Wasser, 7 kg Fett,
8 kg Eiweiß, 2 kg Kalk, 200 g Traubenzucker, 100g Kochsalz, Mineralstoffe
und Enzyme
Es wird aber wohl niemand
behaupten, dass die Summe oder die Mischung dieser Stoffe ein menschliches
Wesen ergeben. Erst wenn diese Stoffe in einem komplizierten System von
Molekülen, Zellen und Organen lebendig miteinander in Beziehung treten,
entsteht ein Lebewesen. Das Schaubild zeigt, wie die einzelnen Systemebenen
nach ihrer Komplexität zusammenhängen: Atome bilden Moleküle.
Moleküle bilden Zellen, Zellen bilden Organe, usw.. Unsere Welt ist
ein verschachteltes System von Systemen:
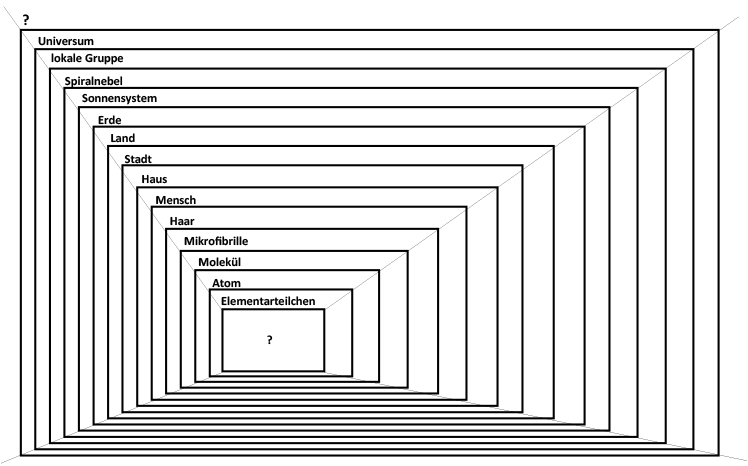 Atome sind in unserer Vorstellung
sehr kleine, grundsätzlich nicht wahrnehmbare Untersysteme der stofflichen
und sichtbaren Materie. Sie haben keine einheitliche Form und können
sich wie eine Wolke relativ schnell verändern. Ein wesentliches Merkmal
von Untersystemen (z.B. Atome) ist ihre völlige Verschiedenartigkeit
zu den Obersystemen (z.B. sichtbarer Stoff), in welche sie eingebaut sind.
So kann ein sichtbarer Stoff für unser Auge farbig erscheinen, dessen
Atome weisen aber überhaupt keine Merkmale auf, welche mit Farbe zu
tun haben. Die Farbe ergibt sich erst aus dem Zusammenwirken vieler Systemglieder.
Atome sind in unserer Vorstellung
sehr kleine, grundsätzlich nicht wahrnehmbare Untersysteme der stofflichen
und sichtbaren Materie. Sie haben keine einheitliche Form und können
sich wie eine Wolke relativ schnell verändern. Ein wesentliches Merkmal
von Untersystemen (z.B. Atome) ist ihre völlige Verschiedenartigkeit
zu den Obersystemen (z.B. sichtbarer Stoff), in welche sie eingebaut sind.
So kann ein sichtbarer Stoff für unser Auge farbig erscheinen, dessen
Atome weisen aber überhaupt keine Merkmale auf, welche mit Farbe zu
tun haben. Die Farbe ergibt sich erst aus dem Zusammenwirken vieler Systemglieder.
Ähnlich
wie die Elemente Aufbausteine für die Welt der Stoffe darstellen,
sind die Atome für die individuelle Existenz
der 118 Elemente verantwortlich. Die Atome wiederum sind aus noch kleineren
Aufbausteinen, den sogenannten Elementarteilchen
aufgebaut:
|
Name
|
Abkürzung (Ladung)
|
Ort
|
Ruhemasse
|
|
Proton
|
p+
|
Atomkern
|
1,6724 x 10-24g
|
|
Neutron
|
n (keine)
|
Atomkern
|
1,6748 x 10-24g
|
|
Elektron
|
e-
|
Atomhülle
|
9,109 x 10-28g
|
Auch den Atombegriff der
Chemie müssen wir als Kunstbegriff ansehen, denn wie ein Atom in Wirklichkeit
aussieht, kann niemals genau vorhergesagt werden. Als sicher gilt jedoch:
Die Art wie die Elementarteilchen miteinander
verknüpft sind, bildet ein System verschiedenartiger Atome. Im Periodensystem
sind die Elemente in aufsteigender Reihenfolge nach der Zahl ihrer Protonen
in den jeweils einzelnen Atomen geordnet. Das Element Nr. 1, Wasserstoff,
mit der Ordnungszahl 1, besitzt demnach 1 Proton, das Element Nr, 2, Helium
2 Protonen, usw.. Die positive Ladung der Protonen im Atomkern wird durch
die negative Ladung der Elektronen ausgeglichen. Das Element Nr. 1 besitzt
immer 1 Proton und 1 Elektron, es gilt:
|
Ordnungszahl = Protonenzahl
= Elektronenzahl.
|
| Zur besseren
Übersicht wurden die Zahlen der Elementarteilchen links neben die
einzelnen Elementsymbolen geschrieben. Die Zahl links nach unten versetzt
gibt gleichzeitig die Ordnungszahl,
die Protonenzahl und die Elektronenzahl des jeweilgen Atoms an. Ein C-Atom
besitzt 6 Protonen im Atomkern und 6 Elektronen in der Atomhülle. |
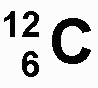
|
Die Zahl links nach oben
versetzt wird auch als Massezahl bezeichnet.
Sie gibt an, wie schwer ein Atom des jeweiligen Elements ist. Da die Elektronen
im Vergleich zu den Kernteilchen eine verschwindend geringe Masse besitzen,
können sie vernachlässigt werden. Daher gilt:
|
Massezahl - Protonenzahl = Neutronenzahl
|
Oft
schreibt man auch nur die Massezahl rechts neben ein Elementsymbol, z.B.
C-12 für das Element Kohlenstoff. Mit aufsteigender Reihenfolge der
Elemente im Periodensystem nimmt die Masse ihrer Atome zu. Aus der Massezahl
kann die Masse in Gramm eines Atoms errechnet werden. Sie ist aber gleichzeitig
in der Chemie eine neue Maßeinheit (u = unit), mit deren Hilfe der
Chemiker chemisch rechnen kann. Es gilt:
|
1 u = 0,000 000 000 000 000
000 000 001 660 Gramm,
das entspricht einem Zwölftel
der Masse eines Kohlenstoffatoms.
Das Kohlenstoffatom besitzt demnach
in der unit-Einheit eine Masse von
12u (=1,66 x 1/1024
Gramm).
|
Diese Zahl steht auch als
Massezahl neben dem Elementsymbol von Kohlenstoff. Meistens wird aber im
Periodensystem als Massezahl eine Zahl mit Kommastellen angegeben. Dies
ist dann der Fall, wenn das in der Natur vorkommende Element in einer Mischung
von zwei verschiedenen Atomsorten vorkommt. Die beiden Atomsorten besitzen
zwar immer gleich viele Protonen im Kern, sie unterscheiden sich jedoch
in ihrer Neutronenzahl. In diesem Fall spricht man von zwei verschiedenen
Isotopen (Nukliden) eines Elements,
die Kommastelle gibt den Durchschnittswert der beiden Isotope an. Das Element
Kalium (mit der Massezahl 39,1) kommt in der Natur aus einem Atomgemisch
dreier verschiedener Isotope mit folgenden Prozentanteilen vor:
|
natürliches Kalium
= Mischung aus 90% K-39 und 10% K-40 und K-41
|
Die Zahl 39,1 ist eine Durchschnittszahl,
die prozentual aus den vorkommenden natürlichen
Isotopen gebildet wird. In der Natur kommen nicht alle Isotope der
Elemente vor. Diese künstlich hergestellten Radioisotope (Radionuklide)
sind radioaktiv, d.h. die Atome zerfallen nach und nach und wandeln sich
in andere Elemente um. Die Halbwertszeit
gibt den radioaktiven Zerfall an: Beträgt die Halbwertszeit von radioaktivem
Plutonium-244 70 Millionen Jahre, dann sind erst nach dieser Zeit die Hälfte
der Atome zerfallen. Andere Radionuklide besitzen eine sehr kurze Halbwertszeit,
die nur wenige Minuten beträgt. Diese sind bei Atomversuchen oder
bei Abfällen aus Kernkraftwerken weniger problematisch.