
|
Kristallines, weißes Pulver |
Molmasse 214,001 g/mol
AGW keine Angaben Dichte 3,89 g/cm3 Zersetzung +560 °C Wasserlöslichkeit 100g H2O lösen bei 20 °C 8,11 g |
| Piktogramm
GHS 03 GHS 07 Gefahr |
Gefahrenklassen
+ Kategorie
Oxidierende Feststoffe 2 Akute Toxizität oral 4 Augenreizung 2 |
HP-Sätze
(siehe auch Hinweis)
H 272, 302, 319 P 210, 221, 280.1-3, 306+360, 305+351+338 Entsorgung G 4 |
| Etikett drucken | Deutscher Name | Englischer Name |
| CAS 7758-05-6 | Kaliumiodat | Potassium iodate |
|
Eigenschaften
Kaliumiodat ist im Handel als kristallines, weißes Pulver erhältlich. Es ist in kaltem Wasser nur mäßig löslich, in heißem Wasser, bei 100 °C, steigt die Löslichkeit auf etwa das Vierfache an. Im Vergleich zum Natriumiodat bilden sich beim Auskristallisieren aus der Lösung nur Kristallklumpen, so dass die Zuordnung zum monoklinen System nicht deutlich sichtbar ist. Bei Mischung des trockenen Stoffs mit brennbaren oder oxidierbaren Stoffen entstehen explosionsgefährliche Gemische oder es treten gefährliche, exotherme Reaktionen auf. 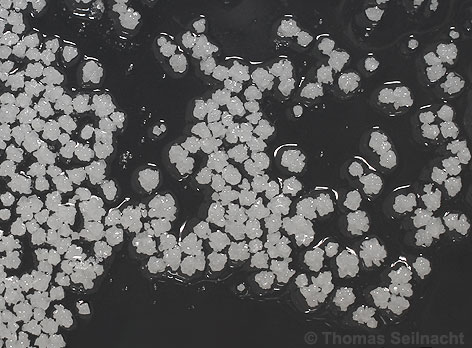 Kaliumiodat kristallisiert aus einer Lösung aus. |
| Herstellung
Bei der
industriellen Herstellung wird eine heiße, konzentrierte
Kaliumchloratlösung mit konzentrierter Salpetersäure und mit
Iod versetzt. Dabei entsteht Chlorsäure HClO3, die mit dem zugesetzten Iod zu Iodsäure HIO3 reagiert. Nach dem Eindampfen wird die Iodsäure mit Kaliumhydroxid neutralisiert. 2 HClO3 + I2 HIO3 + KOH |
| Verwendung
Kaliumiodat wird
zusammen mit Natriumiodat in einer Konzentration von maximal 20ppm zum
Iodieren von Kochsalz verwendet. Es wird auch in Iodtabletten
eingesetzt. In der analytischen Chemie dient es als Urtitersubstanz
für Natriumthiosulfat. Im Chemieunterricht wird Kaliumiodat für die Demonstration der Landolt-Reaktion benötigt: In saurer Lösung reagieren Iodate mit Iodiden zu Iod, das mit zugegebener Stärke eine Blaufärbung zeigt. Die Zugabe von Schwefliger Säure wandelt das Iod zunächst wieder zu Iodid-Ionen um. Erst wenn alle Sulfit-Ionen aufgebraucht sind, tritt die Blaufärbung auf. Durch Einstellen der Temperatur und der Konzentration der Lösungen kann man den Farbumschlag zeitlich exakt vorherbestimmen. Aus diesem Grund ist der Schauversuch auch unter dem Namen „Landoltscher Zeitversuch“ bekannt. Er wurde von dem Schweizer Chemiker Hans Heinrich Landolt (1831–1910) entwickelt. |