Durchführung nur für Lehrkräfte geeignet
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Inhalt
Didaktische Bemerkungen Demonstration 1 Alkalimetalle in einer Flasche Demonstration 2 Eigenschaften des Natriums Demonstration 3 Eigenschaften des Lithiums Demonstration 4 Eigenschaften des Kaliums (Filmeinsatz) Demonstration 5 Eigenschaften des Caesiums und des Rubidiums (Filmeinsatz) Demonstration 6 Reaktionsprodukte bei der Reaktion von Lithium und Wasser Ergänzende Informationen Die Experimente mit den Alkalimetallen als Elementfamilie der 1. Gruppe im Periodensystem verdeutlichen typische Verwandtschaften und Ordnungskriterien. Innerhalb der Familie treten ähnliche Stoffeigenschaften auf, die aber von Element zu Element variieren. Bei den Demonstrationen werden die Alkalimetalle miteinander verglichen und Gemeinsamkeiten und Unterschiede herausgearbeitet. Zunächst zeigt man
die zwei in der Schule gebräuchlichen Alkalimetalle Lithium und Natrium
in der Chemikalienflasche.
Vom Kalium kann ergänzend dazu eine Folie gezeigt
werden. Es müssen
frische Alkalimetallstücke ohne Kruste verwendet
werden. Die Schülerinnen und Schüler sehen, dass
die teilweise glänzenden Metalle
in einer Flüssigkeit aufbewahrt werden. Sie stellen
Hypothesen auf, warum das so ist. Vorerst wird aber nicht verraten, um
welche Flüssigkeit
es sich handelt. Das Lithium schwimmt auf der
Flüssigkeit, während
Natrium (und Kalium) untergetaucht sind.
Demonstration 2 Eigenschaften des Natriums a) Nun holt man mit einer
langen Pinzette ein Stück Natrium aus der Flasche und legt es auf
ein Filterpapier, das in einer Petrischale liegt. Mit einem trockenen Papierhandtuch
wird das weiche Natrium-Stück von der Feuchtigkeit befreit, mit einem
Messer durchschnitten und die frische Schnittfläche in einer Petrischale
liegend den Zuschauern gezeigt. Die Schnittflächen glänzen
für ein paar Sekunden und laufen dann an der Luft relativ schnell
an.
b) Dass das Metall-Stück Strom leitet, lässt sich mit zwei Graphit-Elektroden und einer Messvorrichtung mit Kabel, Glühlampe und Netztrafo zeigen. c) Ein erbsengroßes Stück Natrium wird, falls eine Rinde vorhanden ist, sorgfältig entrindet und mit einem Papierhandtuch getrocknet. Dann füllt man eine runde, hohe Schale zur Hälfte mit Wasser und gibt noch einen Spritzer neutral reagierendes Geschirrspülmittel hinzu, damit das herumsausende Natrium nicht an der Wand festhaftet. Das erbsengroße Natrium-Stück wird mit der Pinzette auf die Wasseroberfläche gelegt. Das Natrium-Stück beginnt zu zischen und formt sich zu einer glänzenden Kugel, die dann auf der Wasseroberfläche herumflitzt. Gelegentlich explodiert das Natrium, was vor allem am Ende der Reaktion vorkommen kann. d) Spätestens jetzt
merken die Schülerinnen und Schüler, dass es sich bei der Schutzflüssigkeit nicht
um Wasser handeln kann. Dass die Reaktion von Natrium und Wasser recht
gefährlich ist, lässt sich zeigen, wenn man das entrindete
Natrium-Stück zuerst auf ein Filterpapier legt und dieses dann auf
dem Wasser schwimmen lässt. Die Gefahr einer Explosion besteht immer
dann, wenn das Natrium sich nicht bewegen kann oder wenn freiwerdender Wasserstoff
eingeschlossen wird.
Die Demonstration wird besonders
eindrücklich wahrgenommen, wenn man dazu eine Geschichte erzählt:
Das Natrium explodiert
in einer gewaltigen Explosion, wobei eine 20 Meter hohe Rauchwolke aufsteigt.
In dem Film hört man noch das Erstaunen der Putzfrau der Schule, die
die Demonstration mit beobachtet. Verkrustetes Natrium und vor allem auch
verkrustetes Kalium dürfen nicht aufbewahrt werden und sind sofort
nach den üblichen Vorschriften zu entsorgen.
Demonstration 3 Eigenschaften des Lithiums a) Die Demonstrationen mit Lithium erfolgen in der Reihenfolge wie beim Natrium: Zuerst holt man mit der Pinzette ein Stück Lithium aus der Flasche und versucht es zu zerschneiden. Dabei wird verdeutlicht, dass wesentlich mehr Kraftaufwand notwendig ist. Der Glanz auf der Schnittfläche bleibt wesentlich länger erhalten.
b) Auch Lithium leitet
den elektrischen Strom.
c) Ein erbsengroßes Stück Lithium wird in eine mit Wasser gefüllte Schale gegeben. Während der Reaktion ist deutlich eine Gasentwicklung sichtbar. Demonstration
4 Eigenschaften
des Kaliums
Achtung: Experimente mit Kalium sollten an Schulen nicht mehr durchgeführt werden. Altes Kalium mit Rinden neigt gelegentlich zur Explosion und hat schon zu schweren Unfällen geführt. Stattdessen bietet es sich an, Videos einzusetzen. Video 1: Beim Zerschneiden eines Kalium-Stückes fährt das Messer wie durch Butter. Die frischen Schnittflächen glänzen nur ganz kurz und oxidieren sofort.
Video 2: Ein erbsengroßes
Stück Kalium wird mit Pinzette und Messer sorgfältig entrindet
und auf einem Papierhandtuch getrocknet. Das Stück wird in eine zur
Hälfte mit Wasser gefüllte große Schale gegeben. Sofort
fängt das Kalium Feuer und verbrennt in einer sehr lebhaften Reaktion
mit violetter Flamme. Gelegentlich explodiert es zum Schluss.
Demonstration
5 Eigenschaften Caesium und Rubidium
Caesium und Rubidium werden aufgrund ihrer Reaktionsfähigkeit mit Luft in Ampullen eingeschmolzen. Daher ist vor einem Öffnen der Ampullen abzuraten. Es kann aber gezeigt werden, dass das Caesium bereits mit Handwärme schmilzt. Faszinierend ist auch die goldgelbe Farbe des Alkalimetalls.
Die
Ampullen enthalten als Füllung ein Schutzgas wie Stickstoff oder Argon.
Wenn man die Ampullen zerschlägt, dann beginnen die Metalle sofort
an zu brennen oder sie explodieren, wenn nur wenig Feuchtigkeit dazukommt.
Zerschlagen
einer Caesium-Ampulle
Demonstration
6 Reaktionsprodukte aus Lithium und Wasser
Früher zeigte man die Entstehung des Wasserstoffs und dessen Nachweis durch die Reaktion von Natrium in einem „Natriumsieb“ unter Wasser. Dieser Versuch sollte heute an Schulen nicht mehr mit Natrium durchgeführt werden. Das Gefahrenpotenzial mit Lithium ist nicht so hoch, daher wird dieser Versuch beschrieben. Es gelten die gleichen Sicherheitsvorkehrungen wie für das Natrium. Es müssen Schutzbrille und Schutzhandschuhe aus Latex angezogen werden, vor allem damit man nicht mit der entstehenden Lauge in Kontakt kommt. Zuvor kann gezeigt werden, wie die Reagenz-Lösung mit Laugen reagiert. Nach dem Füllen der Schale mit Wasser gibt man 10 Tropfen einer Indikator-Lösung hinzu und rührt gut um. Es wird nur ein linsengroßes, sorgfältig von Paraffinöl getrocknetes und entrindetes Stück Lithium in einen Sieblöffel gelegt. 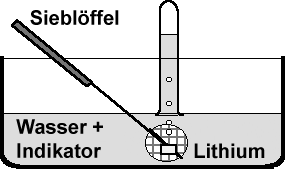 Nun
füllt man ein Reagenzglas (20×180mm) mit Wasser und verschließt
es mit dem Daumen. Das Reagenzglas wird unter Wasser getaucht und erst
dann geöffnet. Nach dem Eintauchen des Sieblöffels fängt man
das entstehende Gas pneumatisch im Reagenzglas auf. Nach dem Ende der Reaktion
führt man eine Knallgas-Probe durch und verweist auf die rote Farbe
in der Schale. Die Schülerinnen und Schüler versuchen selbst, eine Reaktionsgleichung
zu formulieren.
Erklärungen: Das Lithium reagiert mit dem Wasser in einer exothermen Reaktion zu Wasserstoff und einer Lauge. Der Wasserstoff lässt sich mit der Knallgasprobe nachweisen, die Lauge durch die Pinkfärbung des Phenolphthaleins: 2 Li + 2 H2O Variationen: Die
Laugen-Bildung bei der Reaktion von Alkalimetallen mit
Wasser lässt
sich auch schön zeigen, wenn man kleine
Lithium-Stücke in eine auf einem Overheadprojektor stehende Schale
mit Wasser
wirft, die zuvor mit einem Indikator versetzt wurde. Der Name der Alkalimetalle
leitet sich vom arabischen Wort al kali ab, welches das in der Pflanzenasche
enthaltene Kaliumcarbonat bezeichnet.
Dieses bildet mit Wasser eine Lauge. Sir Humphry
Davy stellte im Jahr 1807 erstmals das Element Kalium durch eine Schmelzflusselektrolyse
aus Kaliumhydroxid dar. Letzteres gewann er aus Kaliumcarbonat.
Alle Elemente der Gruppe, also Lithium, Natrium, Kalium, Rubidium, Cäsium und Francium, reagieren heftig mit Wasser unter Wasserstoff- und Laugen-Bildung. Sie sind relativ weich und leiten den elektrischen Strom. Mit absteigender Reihenfolge im Periodensystem nehmen die Reaktionsfähigkeit und die Dichte zu. Schmelzpunkt und Härte nehmen tendenziell ab. Lithium, Kalium und Natrium sind die Elemente mit der geringsten Dichte, Caesium und Rubidium die Elemente mit der geringsten Härte. Die hohe Reaktionsfähigkeit
der Alkalimetalle erklärt sich in dem einzigen Valenzelektron in der Valenzschale. Dieses kann leicht abgegeben
werden. Die Atome der Alkalimetalle besitzen eine sehr niedrige Elektronegativität.
Bei den Alkalimetallen tritt daher generell die Oxidationsstufe +1 auf.
Bringt man eine Lithium- oder eine Natrium-Verbindung in eine Flamme, kommt es zu einer typischen Flammenfärbung (>Schülerübung). Die Lithium- oder Natrium-Atome senden dabei Licht von ganz bestimmter Wellenlänge aus. Zur Erklärung des
Phänomens wird die Funktionsweise eines Spektroskops erläutert:
Sendet man weißes Sonnenlicht durch ein Prisma, erscheinen die Farben
des Regenbogens. Das Sonnenlicht wird durch das Prisma in seine verschiedenen Wellen-Anteile zerlegt. Man erhält ein kontinuierliches Spektrum. Der hierbei sichtbare
Bereich des Lichts wird auch als optisches Spektrum bezeichnet. Bei den
Flammenfärbungen durch die Alkalimetalle wird nur ein bestimmter Ausschnitt
aus dem optischen Spektrum ausgestrahlt. Dieser Ausschnitt nennt man
Linienspektrum und ist für jede Atom-Sorte typisch.
Mit Hilfe eines Spektroskops
lassen sich die Linienspektren erkennen. Auf diese Art und Weise entdeckten
Robert Wilhelm Bunsen und Gustav Robert Kirchhoff im Jahr 1861 bei spektralanalytischen
Untersuchungen des Minerals Lepidolith anhand der bis dahin noch nicht
bekannten Linienspektren die Elemente Rubidium und Caesium.
Um zu zeigen, dass es
im Periodensystem bestimmte Ordnungen
und Elementgruppen gibt, kann man
im Anschluss die Erdalkalimetalle im Unterricht besprechen. Auch bei ihnen nimmt die Reaktionsfähigkeit
mit absteigender Reihenfolge im Periodensystem zu. Mit Ausnahme des Berylliums
reagieren sie gerne mit Wasser und bilden dabei alkalische Lösungen.
Alternativ zu den Experimenten bieten sich auch hier Filme
zu den Erdalkalimetallen an. |