Glycerin
C3H5(OH)3
Glycerin
Propan-1,2,3-triol
1,2,3-Propantriol
Propan-1,2,3-triol
1,2,3-Propantriol
Glycerol
Propane-1,2,3-triol
1,2,3-Propanetriol
Propane-1,2,3-triol
1,2,3-Propanetriol
Molmasse
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Brechungsindex
Explosionsgrenzen
Flammpunkt
Zündpunkt
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Brechungsindex
Explosionsgrenzen
Flammpunkt
Zündpunkt
92,094 g/mol
200 mg/m3 E (TRGS 900)
1,2613 g/cm3
+18,2 °C
+289 °C
vollständig mischbar
1,4746 (bei 20 °C)
3 bis 19 Vol.-% (Luft)
+199 °C
+370 °C
200 mg/m3 E (TRGS 900)
1,2613 g/cm3
+18,2 °C
+289 °C
vollständig mischbar
1,4746 (bei 20 °C)
3 bis 19 Vol.-% (Luft)
+199 °C
+370 °C
Klare, viskose Flüssigkeit

Glycerin kommt im Stoffwechsel vor. Man findet es in zahlreichen Fetten und Ölen der Tiere und Pflanzen.
Wirkung auf den menschlichen Körper
Die geruchlose, süßlich schmeckende, schwer bewegliche und hygroskopische (wasseranziehende) Flüssigkeit wirkt beim Verschlucken bis zu einer Menge von 50 Milliliter relativ harmlos. Bei größeren Mengen kommt es zu einem Rauschzustand mit Kopf- und Nierenschmerzen. Bei Kontakt mit der unverdünnten Flüssigkeit auf der Haut kann es leichte Reizungen geben.
Chemisch-physikalische Eigenschaften
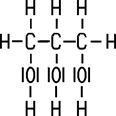
Glycerin gehört aufgrund seiner drei Hydroxy-Gruppen (OH-Gruppen) im Molekülbau zu den dreiwertigen Alkoholen. Das Glycerin-Molekül ist stark polar und daher gut wasserlöslich. Unterhalb des Schmelzpunktes erstarrt wasserfreies Glycerin zu Kristallen. Die drei OH-Gruppen ermöglichen eine gute Reaktionsfähigkeit: Mit getrocknetem Kaliumpermanganat reagiert Glycerin zunächst unter Rauchbildung. Die dabei entstehende Wärme beschleunigt die exotherme Reaktion so stark, dass eine Stichflamme herausschlägt. Als Reaktionsprodukte bilden sich verschiedene Manganverbindungen wie Kaliummanganat(VI), Mangan(IV)-oxid und Mangan(III)-oxid. Das Glycerin wird dabei zu Wasser und Kohlenstoffdioxid oxidiert.

Glycerin reagiert mit Kaliumpermanganat.
Dieser Versuch ist nur bedingt für Schulen geeignet. Film erhältlich auf >DVD
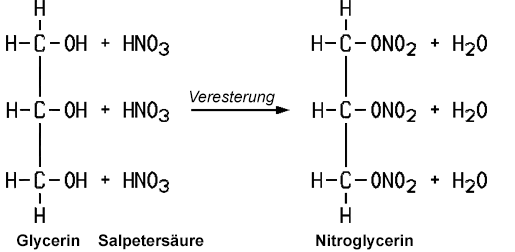
Glycerin ist oxidierbar, wobei Glycerinaldehyd und Dihydroxyaceton entsteht. Mit Salpetersäure erhält man Glycerinsäure. Verwendet man jedoch eine Nitriersäure aus rauchender Salpetersäure und konzentrierter Schwefelsäure verestern die Hydroxy-Gruppen zu Trisalpetersäureglycerinester. Dieser Ester ist unter dem Namen Nitroglycerin bekannt, das ein hochbrisanter und schlagempfindlicher Sprengstoff ist. Auch die Herstellung ist mit großen Risiken verbunden. Der schwedische Chemiker und Industrielle Alfred Nobel (1833–1896) entwickelte ein Verfahren, wie man das Nitroglycerin stabilisieren kann. Beim Aufsaugen mit Kieselgur verliert es seine schlagempfindliche Eigenschaft, und es lässt sich nur noch mit einem Detonationszünder zur Explosion bringen. Nobel wurde mit der Erfindung des Dynamits sehr reich. Allerdings war der Preis sehr hoch. Bei Explosionsunfällen während der Produktion kamen einige Arbeiter und auch sein eigener Bruder ums Leben.
Nitroglycerin ist in geringer Dosis ein bedeutendes Herzmedikament. Es wirkt stark gefäßerweiternd und wird bei Angina Pectoris und der damit verbundenen Atemnot oder bei einem drohenden Herzinfarkt eingenommen. Die abgebildeten Kapseln enthalten 0,8 Milligramm Nitroglycerin:
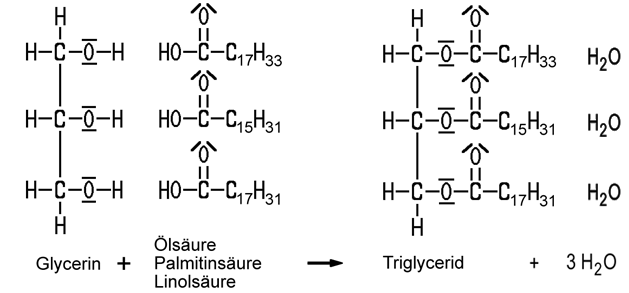
Mit Säuren bildet Glycerin zahlreiche Ester. Fette bestehen beispielsweise aus Triglyceriden, die durch die Veresterung aller drei Hydroxy-Gruppen des Glycerins mit Carbonsäuren zugänglich sind:
Die geruchlose, süßlich schmeckende, schwer bewegliche und hygroskopische (wasseranziehende) Flüssigkeit wirkt beim Verschlucken bis zu einer Menge von 50 Milliliter relativ harmlos. Bei größeren Mengen kommt es zu einem Rauschzustand mit Kopf- und Nierenschmerzen. Bei Kontakt mit der unverdünnten Flüssigkeit auf der Haut kann es leichte Reizungen geben.
Chemisch-physikalische Eigenschaften
Glycerin gehört aufgrund seiner drei Hydroxy-Gruppen (OH-Gruppen) im Molekülbau zu den dreiwertigen Alkoholen. Das Glycerin-Molekül ist stark polar und daher gut wasserlöslich. Unterhalb des Schmelzpunktes erstarrt wasserfreies Glycerin zu Kristallen. Die drei OH-Gruppen ermöglichen eine gute Reaktionsfähigkeit: Mit getrocknetem Kaliumpermanganat reagiert Glycerin zunächst unter Rauchbildung. Die dabei entstehende Wärme beschleunigt die exotherme Reaktion so stark, dass eine Stichflamme herausschlägt. Als Reaktionsprodukte bilden sich verschiedene Manganverbindungen wie Kaliummanganat(VI), Mangan(IV)-oxid und Mangan(III)-oxid. Das Glycerin wird dabei zu Wasser und Kohlenstoffdioxid oxidiert.
Glycerin reagiert mit Kaliumpermanganat.
Dieser Versuch ist nur bedingt für Schulen geeignet. Film erhältlich auf >DVD
Glycerin ist oxidierbar, wobei Glycerinaldehyd und Dihydroxyaceton entsteht. Mit Salpetersäure erhält man Glycerinsäure. Verwendet man jedoch eine Nitriersäure aus rauchender Salpetersäure und konzentrierter Schwefelsäure verestern die Hydroxy-Gruppen zu Trisalpetersäureglycerinester. Dieser Ester ist unter dem Namen Nitroglycerin bekannt, das ein hochbrisanter und schlagempfindlicher Sprengstoff ist. Auch die Herstellung ist mit großen Risiken verbunden. Der schwedische Chemiker und Industrielle Alfred Nobel (1833–1896) entwickelte ein Verfahren, wie man das Nitroglycerin stabilisieren kann. Beim Aufsaugen mit Kieselgur verliert es seine schlagempfindliche Eigenschaft, und es lässt sich nur noch mit einem Detonationszünder zur Explosion bringen. Nobel wurde mit der Erfindung des Dynamits sehr reich. Allerdings war der Preis sehr hoch. Bei Explosionsunfällen während der Produktion kamen einige Arbeiter und auch sein eigener Bruder ums Leben.

Nitroglycerin ist in geringer Dosis ein bedeutendes Herzmedikament. Es wirkt stark gefäßerweiternd und wird bei Angina Pectoris und der damit verbundenen Atemnot oder bei einem drohenden Herzinfarkt eingenommen. Die abgebildeten Kapseln enthalten 0,8 Milligramm Nitroglycerin:
Mit Säuren bildet Glycerin zahlreiche Ester. Fette bestehen beispielsweise aus Triglyceriden, die durch die Veresterung aller drei Hydroxy-Gruppen des Glycerins mit Carbonsäuren zugänglich sind:

Die Entdeckung des Glycerins wird dem schwedischen Chemiker Carl Wilhelm Scheele (1742–1786) zugeschrieben. Bei der Einwirkung des Pigments Bleiglätte (Blei(II)-oxid) auf Olivenöl erhielt Scheele eine süß schmeckende, ölige Flüssigkeit, die er zunächst „Ölsüß“ nannte. Die Rolle des Glycerins bei der Seifenbildung wurde vom französischen Chemiker Michel-Eugène Chevreul (1786–1889) im Jahr 1823 aufgeklärt. Früher gewann man das Glycerin bei der Seifenherstellung als Nebenprodukt. Heute erfolgt die Herstellung hauptsächlich aus Propen, einem Produkt beim Cracken von langkettigen Alkanen. Das Propen wird zuerst zu Allylchlorid (CH2=CH-CH2Cl) chloriert, das dann über mehrere Zwischenschritte zu Glycerin umgewandelt wird. Ein weiteres wichtiges Verfahren ist die Hydroxylierung von Allylalkohol mit Wasserstoffperoxid und einem Wolframoxid-Katalysator.
Glycerin wird in großem Umfang zur Herstellung von Kunststoffen wie Polyurethanschäume und von Farbstoffen benötigt. In Cremes und Salben ist es als Feuchthaltemittel enthalten. Im Auto findet man es in der Bremsflüssigkeit und im Frostschutzmittel. Es dient auch als Weichmacher für Filme oder als wasseranziehender Zusatz für Farbbäder, Kopiertinten, sowie für Druck- und Stempelfarben. Durch eine Veresterung mit Salpetersäure entsteht Nitroglycerin. Dieser Sprengstoff ist die Grundkomponente des Dynamits.

© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen