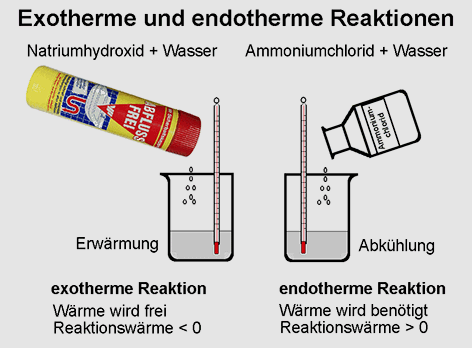
Jede chemische Reaktion ist mit einem Energieumsatz
verbunden. Beispiele: Beim Verbrennen von Butangas im Kartuschenbrenner oder beim Lösen von „Abfluss frei“ (mit Natriumhydroxid) Natriumhydroxid in Wasser wird Wärmeenergie frei. Beim Lösen von Ammoniumchlorid
in Wasser oder bei der Herstellung von Kältemischungen kühlt
sich die Lösung ab, da Wärmeenergie benötigt wird.
Bei exothermen
Reaktionen wird Energie frei, bei endothermen
Reaktionen wird Energie benötigt. In der Chemie wird die frei
werdende oder benötigte Wärmeenergie als Reaktionswärme
(oder als Reaktionsenthalpie) bezeichnet. Die bei einer chemischen Reaktion
insgesamt frei werdende Wärmemenge Q (Maßeinheit: Joule), kann
mit einem Kalorimeter gemessen werden (siehe Versuchsbeschreibung
und Berechnung). Meistens wird die Reaktionswärme jedoch auf die Stoffmenge n der beteiligten Stoffe in Joule pro Mol
bezogen:
Formelzeichen: ΔHR (delta HR)
Maßeinheit: Joule pro Mol
Da chemische Reaktionen
mit Energieaufnahme oder -abgabe verbunden sind, muss jedem Stoff eine
bestimmte Energiemenge zugeschrieben werden. Diese Energie nennt man Enthalpie
(Formelzeichen H). Die Enthalpie jedes Stoffes hängt von der
Temperatur und vom Außendruck ab. Daher werden die Angaben für die Enthalpie
auf den Standardzustand bezogen:
Standardzustand in der Thermochemie: 298,15 Kelvin und 1013 Millibar
(298,15 Kelvin sind etwa 25 °C)
Achtung: Der Standardzustand
in der Thermochemie entspricht nicht dem Normalzustand bei 0 °C!
Da absolute Enthalpien nicht messbar sind, legte man für die Enthalpien
der Elemente im Standardzustand die Zahl 0 fest. Beispiel: Bei der Reaktion
von Eisen und Schwefel entsteht Eisensulfid:
Fe + S
In diesem
Fall erhalten die Elemente Fe und S den Betrag 0, während dem FeS
die bei der exothermen Reaktion freigesetzte Bildungswärme ΔHB zugeordnet wird. Unter der Bildungswärme
versteht man die Wärmemenge, die bei der Bildung einer bestimmten
Verbindung aus den Elementen unter Standardbedingungen freigesetzt oder
verbraucht wird. Sie erhält folgendes Formelzeichen:
Bildungswärme: ΔHB
Bildungswärme: ΔHB
Mit Hilfe der Enthalpien
lässt sich die Reaktionswärme neu definieren. Die
Reaktionswärme ist die Differenz der Summen aller
Bildungswärmen der Ausgangs- und der Endstoffe:
ΔHR = ∑ΔHB (Endstoffe) − ∑ΔHB (Ausgangsstoffe)
ΔHR = ∑ΔHB (Endstoffe) − ∑ΔHB (Ausgangsstoffe)
Bei exothermen Reaktionen ergibt sich für die Reaktionswärme ΔHR
aufgrund der Formel ein Wert kleiner als 0, bei endothermen Reaktionen
größer als 0. Die Bildungswärme ist ein ungefähres
Maß für die Stabilität einer chemischen Verbindung. Je
mehr Wärmeenergie bei der Bildung einer Verbindung freigesetzt
wird, desto stabiler ist sie.
Übungsbeispiel 1
Errechnen Sie die molare Reaktionswärme für die Reaktion zwischen Eisen und Schwefel:
Fe + S FeS
FeS
Übungsbeispiel 1
Errechnen Sie die molare Reaktionswärme für die Reaktion zwischen Eisen und Schwefel:
Fe + S
Aus Tabellen
kann die Bildungswärme des Eisensulfids abgelesen werden. Die
Elemente Fe und S erhalten die Werte 0. Somit gilt nach Einsetzen in
obige Gleichung:
ΔHR = −100kJ − (0 + 0) = −100 kJ/mol
Übungsbeispiel 2
Errechnen Sie die Reaktionswärme für die Reaktion im Hochofen:
Übungsbeispiel 2
Errechnen Sie die Reaktionswärme für die Reaktion im Hochofen:
Fe2O3
+ 3 CO  2 Fe
+ 3 CO2
2 Fe
+ 3 CO2
ΔHR = [2 × 0 + 3 × (−393kJ)] − [−824 kJ + 3 × (−111 kJ)] = −22 kJ/mol
Beide Reaktionen verlaufen aufgrund des negativen Vorzeichens exotherm. Zur eindeutigen Kennzeichnung der beteiligten Stoffe ergänzt man in den Formeln den vorliegenden Aggregatzustand der Stoffe durch ein Symbol mit Klammer. Die Kennzeichnung ist notwendig, da die Bildungswärmen beispielsweise von Wasser und Wasserdampf unterschiedlich sind. Es bedeutet:
ΔHR = [2 × 0 + 3 × (−393kJ)] − [−824 kJ + 3 × (−111 kJ)] = −22 kJ/mol
Beide Reaktionen verlaufen aufgrund des negativen Vorzeichens exotherm. Zur eindeutigen Kennzeichnung der beteiligten Stoffe ergänzt man in den Formeln den vorliegenden Aggregatzustand der Stoffe durch ein Symbol mit Klammer. Die Kennzeichnung ist notwendig, da die Bildungswärmen beispielsweise von Wasser und Wasserdampf unterschiedlich sind. Es bedeutet:
Die Reaktionswärmen der chemischen Reaktionen misst man mit einem Kalorimeter. Manchmal
lassen sich die Reaktionswärmen jedoch nicht direkt mit dem
Kalorimeter messen, zum Beispiel bei der Bestimmung der
Bildungswärme von Kohlenstoffmonooxid. Bei der Verbrennung von Kohlenstoff entsteht neben Kohlenstoffmonooxid auch immer Kohlenstoffdioxid. Folgende Reaktionswärmen lassen sich aber messen:
C (s) + O2 (g)
CO (g) + ½ O2 (g)
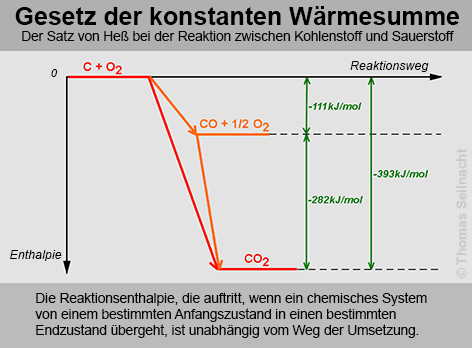
Hier hilft das Gesetz der konstanten Wärmesummen. Das Gesetz wird oft auch mit dem Satz von Heß beschrieben:
Nach dem Satz von Heß
erhält man bei der Verbrennung von Kohlenstoff zu Kohlenstoffdioxid
gleich viel Wärme, wie bei der Verbrennung über die Zwischenstufe
über das Kohlenstoffmonooxid. Aus der Grafik kann abgelesen werden,
dass die Bildungsenthalpie von Kohlenstoffmonooxid −111 kJ/mol beträgt.
Tabelle Bildungsenthalpien
Buch individuell erstellen: Basis-Text Reaktionswärme, Enthalpie


> Inhaltsverzeichnis
Tabelle Bildungsenthalpien
Buch individuell erstellen: Basis-Text Reaktionswärme, Enthalpie


> Inhaltsverzeichnis