Nur für Lehrkräfte und erfahrene Praktikumsteilnehmer geeignet
Inhalt
Didaktische Bemerkungen Demonstration 1 Reaktionswärme der Holzkohle bestimmen Demonstration 2 Lösungswärmen der Salze bestimmen Demonstration 3 Bildungswärme bei der Reaktion von Eisen und Schwefel bestimmen Ausblick Chemische
Reaktionen sind stets mit einem Energieumsatz verbunden. Diese Erfahrung entspricht auch den Alltagserfahrungen,
beispielsweise beim Verbrennen von Heizöl oder von Holzkohle. Eine
Hinführung
zu diesem Thema erfolgte im Unterricht zuvor bei verschiedenen
Experimenten
(„Kupfer und Schwefel“), bei den Schülerübungen oder bei den Sulfid-Reaktionen. Es
soll nun demonstriert werden, dass die frei werdende Reaktionswärme
nicht nur qualitativ wahrgenommen, sondern auch quantitativ gemessen und
berechnet werden kann.
Zunächst wiegt man ein Holzkohlestückchen mit maximal 0,3 Gramm auf einer Waage ab und bestimmt die Masse auf zwei Stellen hinter dem Komma genau. Danach wird ein Kalorimeter in ein Stativ gespannt und mit der erforderlichen Menge destilliertes Wasser gefüllt (meist 0,5 Liter). Die genaue Masse des Wassers kann mit einem Messzylinder oder mit einer Waage bestimmt werden. Das Eingangsrohr unterhalb des Kalorimeters wird an eine mit Kalkwasser gefüllte Gaswaschflasche angeschlossen. Diese verbindet man mit der Sauerstoffflasche und stellt einen schwachen Gasstrom ein (etwa 2 bis 3 Blasen pro Sekunde). Nun erfolgt eine genaue
Messung der Wassertemperatur. Danach wird ein kleines Stück Holzkohle
(maximal 0,3 Gramm!) mit der Tiegelzange über der nichtleuchtenden Brennerflamme
an den Rändern zum Glühen gebracht und zügig in die Halterung
des Kalorimeters eingesetzt. Der Kalorimeter sollte dann sofort verschlossen
werden. Achtung: Die Sauerstoffzufuhr muss eventuell gedrosselt werden,
vor allem wenn die Holzkohle zu stark aufglüht oder der Korken gar
Feuer fängt!
Während des Verbrennens der Holzkohle wird der Rührstab gelegentlich auf und ab bewegt. Dies wird auch eine Weile nach dem vollständigen Verglühen des Kohlestückchens fortgesetzt. Danach liest man die Temperatur erneut ab und bestimmt die Temperaturdifferenz. Beobachtung: Das glimmende Holzkohlestückchen glüht nach der Sauerstoffzufuhr hell auf. Gelegentlich beschlägt das Innere des Kalorimeters mit Wasserdampf. Die Verbrennung liefert Wärme, die das Wasser des Kalorimeters aufheizt. Die Temperaturzunahme kann an dem Thermometer abgelesen werden. Die Temperatur erreicht nach dem Ende der Verbrennung ihr Maximum. Theorie: Bei der Verbrennung der Holzkohle wird Wärme frei, die das Wasser im Kalorimeter aufheizt. Die Reaktionsgleichung für die Verbrennung von Kohlenstoff lautet: C + O2 Die angegebene Reaktionswärme ΔHR bezieht sich auf die Stoffmenge von 12 Gramm Kohlenstoff (1 Mol). Zunächst soll jedoch die absolute Wärmemenge Q berechnet werden. Die Berechnung erfolgt unter Einbeziehung der spezifischen Wärmekapazität (cP) des Wassers: Q = cP (Wasser) × m (Wasser) × ΔT Zur Erwärmung von 1 Gramm Wasser um 1 Kelvin (1° Celsius), sind (bei konstantem Druck) 4,19 Joule notwendig. Die Wärmekapazität des Kalorimeters soll hierbei vernachlässigt werden. Beispiel: Bei einer Messung erwärmen 0,3 Gramm Holzkohle 500 Gramm Wasser um 4,3 Kelvin oder 4,3 °C: Q = 4,19 J/(g × K) × 500g × 4,3K = 9008,5 Joule Bei der Verbrennung von 0,3 Gramm Holzkohle werden also 9008,5 Joule frei. Nun wird die Reaktionswärme bezogen auf die Stoffmenge des Kohlenstoffs berechnet. 0,3 Gramm Kohlenstoff entsprechen der Stoffmenge von 0,025 Mol. Die Reaktionswärme bei 1 Mol Kohlenstoff beträgt also: ΔHR = −9008,5 Joule/0,025mol = −360340 Joule/mol = −360,34 kJ/mol Der errechnete Wert erhält ein negatives Vorzeichen, da bei der Reaktion Energie frei wird. Bei einem Vergleich mit dem theoretischen Wert (−393 kJ/mol) zeigt sich eine Abweichung, die durch bestimmte Faktoren verursacht werden kann: Die spezifische Wärmekapazität des Kalorimeters wurde nicht berücksichtigt. Bei der Verbrennung der Holzkohle wurde nicht nur das Wasser erwärmt, sondern auch das Glas und die umgebende Luft des Kalorimeters. Diese Wärmemenge floss nicht in das Wasser. Wird die Wärmekapazität der Kalorimeters mit berücksichtigt (200 J/g × K), erfolgt die Berechnung nach einer erweiterten Gleichung: Q = 4,19 J/(g × K) × 500g × 4,3K + 200J/(g × K) × 4,3K = 9868,5 Joule ΔHR = −9868,5 Joule/0,025mol = −394740 Joule/mol = −394,74 kJ/mol Die Holzkohle ist vielleicht
mit Wasser oder mit Kohlenwasserstoffen verunreinigt. Der innere Beschlag
im Kalorimeter deutet eventuell darauf hin. Beim Zünden des Holzkohle-Stückchens
mit dem Brenner außerhalb des Kalorimeters geht bereits Wärme
verloren. Die Abweichungen sollten diskutiert werden, weil durch sie das
Prinzip der Messung von den Schülern besser verstanden wird.
Beim Lösen von Salzen in Wasser zerfallen die Ionenbindungen in Ionen, wobei ebenfalls Wärme abgegeben oder aufgenommen wird. Löst man das Salz Kaliumnitrat in Wasser, findet eine Abkühlung statt, da beim Lösungsvorgang Energie aus der Umgebung benötigt wird: KNO3 Andere Salze führen beim Lösen in Wasser zu einer Erwärmung, z.B. beim Natriumhydroxid: NaOH In einer Schülerübung (>Arbeitsblatt) bestimmen
die Schüler die absoluten Wärmemengen und die molaren Lösungswärmen
selbst und vergleichen dann mit den theoretischen Werten (siehe auch Tabellen zu den Bildungsenthalpien
der Ionen). Auch hier soll die spezifische Wärmekapazität
der verwendeten Gefäße vernachlässigt werden.
Bei der exothermen Sulfid-Reaktion von Eisen und Schwefel wird viel Energie frei: Fe + S 7g Eisenpulver werden in einer Reibschale mit 4 Gramm Schwefel vermischt. Von dem Gemisch wiegt man auf einer Waage genau 8,8 Gramm ab und füllt es in ein kleineres Reagenzglas (16×180mm). Ein Becher aus dünnem, transparentem Kunststoff, der in einem zweiten steht, wird mit genau 250 Gramm (250ml) Wasser gefüllt. Der genaue Aufbau der Apparatur ist der Zeichnung zu entnehmen: 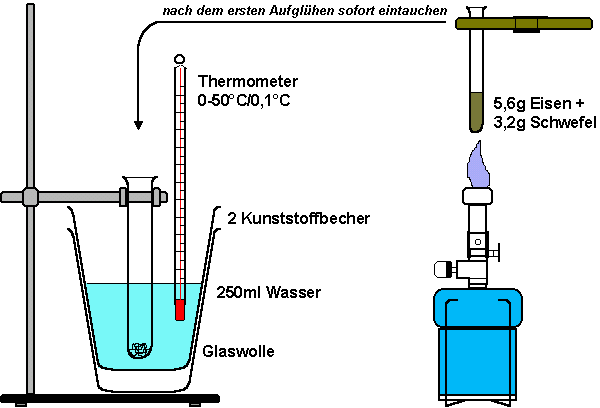
Am Boden des größeren
Reagenzglases, welches in das Wasser taucht, befindet sich wenig Glaswolle. Die Wassertemperatur wird auf 0,1 °C genau
gemessen. Danach erhitzt man das Gemisch im Reagenzglas mit der nicht leuchtenden
Brennerflamme solange, bis es zu glühen beginnt. Das Reagenzglas wird
möglichst rasch in das ins Wasser getauchte Reagenzglas hinein gestellt.
Der Thermometer sollte während der Reaktion aus Sicherheitsgründen
nicht in das Wasser gehalten werden. Nach Beendigung der Reaktion rührt
man mit dem Thermometer vorsichtig um und liest danach die höchste,
erreichbare Temperatur ab.
Beobachtungen: Das Eisen-Schwefel-Gemisch glüht hell auf, die Glut-Zone wandert durch das Gemisch. Dabei erwärmt sich das Wasser im Becher. Theorie: Bei diesem Versuch entspricht die absolute Wärmemenge Q genau einem Zehntel der molaren Reaktionswärme ΔHR, da 5,6 Gramm Eisen und 3,2 Gramm Schwefel (total =8,8 Gramm) genau 0,1 Mol der beteiligten Stoffe entsprechen: Q = cP (Wasser) × m (Wasser) × ΔT Berechnung eines Versuchs, bei dem sich das Wasser um 8,6 Kelvin (°C) erwärmt: Q = 4,19 J/(g × K) × 250g × 8,6K = 9008,5 Joule ΔHB = −9008,5 Joule/0,1mol = −90085 Joule/mol = −90,085 kJ/mol Aufgrund der exothermen
Reaktion erhält die errechnete Bildungswärme ein negatives Vorzeichen.
Der Vergleich mit dem theoretischen Wert (−100kJ/mol) zeigt eine Abweichung
von etwa 10%. Auch hier erscheint eine Fehlerdiskussion sinnvoll:
Im Anschluss kann die Reaktionswärme
aus der Differenz der Summen aller Bildungswärmen der Ausgangs- und
der Endstoffe berechnet werden. Da Eisen und Schwefel zu Beginn als Element
vorliegen, wird für sie der Wert 0 eingesetzt:
ΔHR = ∑ΔHB (Endstoffe) − ∑ΔHB (Ausgangsstoffe)
für die Reaktion Fe + S ΔHR = −100kJ − (0 + 0) = −100 kJ/mol Ausblick Die Berechnung der Reaktionswärmen kann an weiteren Übungsbeispielen verdeutlicht werden. Die Messung von Neutralisationswärmen bei der Neutralisation von Natronlauge durch Schwefelsäure und die Bestimmung der Reaktionswärmen bei Redoxreaktionen, wenn man zum Beispiel Zinkpulver zu einer Kupfer(II)-sulfat-Lösung in einem Thermosbehälter gibt, dienen zur weiteren Vertiefung. |