|
Haber-Bosch-Verfahren
|
|||
Wilhelm Ostwald entwickelte ein Laborverfahren, um Ammoniak aus Stickstoff und Wasserstoff herzustellen. Er meldete im Jahr 1900 ein entsprechendes Patent an und verkaufte es danach an die BASF. Das industrielle Verfahren
zur Ammoniaksynthese wurde zwischen 1905 und 1913 durch den deutschen Chemiker Fritz
Haber unter der Leitung des Ingenieurs Carl Bosch (1874−1940) entwickelt. Die Optimierung des dafür geeigneten Katalysators erfolgte durch den deutschen Chemiker Alwin Mittasch (1869−1953).
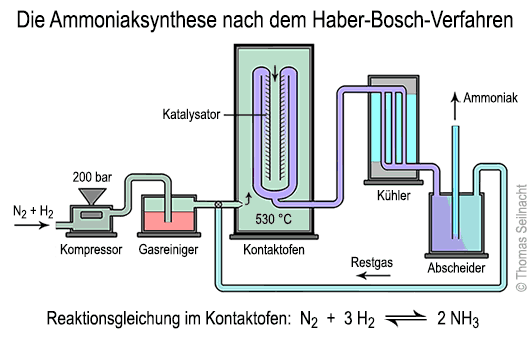
Die Entwickler fanden durch langjährige Versuche heraus, dass für die Gleichgewichts-Reaktion zwischen Stickstoff und Wasserstoff unter folgenden Bedingungen am meisten Ammoniak gebildet wird:
1. In einem Kompressor wird das Gasgemisch aus Stickstoff und Wasserstoff auf den notwendigen Druck komprimiert. Heute verwendet man Turbokompressoren, die mit einer Dampfturbine angetrieben werden. 2. In einem Gasreiniger wird das Gasgemisch von unerwünschten Verunreinigungen wie Schwefelverbindungen oder Kohlenmonoxid gereinigt. 3. Im Kontaktofen läuft die eigentliche Reaktion nach der oben beschriebenen Reaktionsgleichung ab. In einem zylinderförmigen, druckfesten Reaktionsrohr wird das Gasgemisch unter Druck auf bis zu 530 °C erhitzt. Dabei strömt das Gasgemisch durch den porösen Katalysator und reagiert zu Ammoniakgas. Fritz Haber und G. van Oordt verwendeten schon 1904 reines Eisen, das aber noch nicht in der richtigen Modifikation vorlag. 1909 experimentierte Haber mit Osmium und sogar mit Uran als Katalysator. Alwin Mittasch suchte in den Folgejahren nach der optimalen Zusammensetzung für den Katalysator. Er fand heraus, dass eine bestimmte Eisenmodifikation am besten geeignet ist. Magnetit oder Eisen(II,III)-oxid Fe3O4 wird in der reduzierend wirkenden Umgebung des Reaktors zu stark porösem, kubisch-raumzentriertem α-Eisen umgewandelt. Die innere Oberfläche dieses Eisens ist sehr hoch und ermöglicht einen hohen Gas-Kontakt. Wenig zugesetztes Aluminiumoxid begünstigt die Bildung des α-Eisens, Kaliumoxid stabilisiert die Struktur. Außen ist das Reaktionsrohr mit druckbeständigem, dickem Stahl verstärkt. Innen darf kein Stahl verwendet werden, weil der Wasserstoff mit dem im Stahl enthaltenen Kohlenstoff reagieren würde. Deshalb besteht das Innenrohr aus kohlenstoffarmem, reinem Eisen. 4. Im Kühler wird das noch heiße Ammoniakgas abgekühlt. Die Kühlung erfolgt in mehreren Stufen durch Wärmeaustausch mit Kühlwasser und mit schon erkaltetem Gas. 5. Im Abscheider wird das Ammoniakgas von nicht umgesetzten Ausgangsprodukten wie Wasserstoff und Stickstoff getrennt. Im Kontaktofen setzen sich trotz optimaler Reaktionsbedingungen nur etwa 20% der Ausgangsstoffe in Ammoniak um. Die nicht umgesetzten Rest-Gase werden vor dem Kontaktofen wieder eingeführt. Das Gas Ammoniak NH3 ist in der Chemie ein wichtiges Zwischenprodukt. 90% aller Düngemittel werden heute aus Ammoniak gewonnen. Außerdem kann man aus Ammoniak Salpetersäure herstellen. Wasserstoff und Stickstoff lassen sich aus Erdgas nach der Synthesegas-Erzeugung gewinnen. Fritz Habers erste Versuchsanlage zur Ammoniaksynthese, ausgestellt im Deutschen Museum in München. Serienbilder zur Ammoniaksynthese
Zur Ammoniaksynthese liegt eine Serie in 9 Bildern zur Lösungskontrolle vor. Die Lösungen werden beim Durchklicken im Vollbildmodus nach und nach eingeblendet. Die Serie kann zur Erarbeitung des Arbeitsblattes verwendet werden. Es liegt auch ein Text vor, den man gleichzeitig vorlesen kann.   Serie starten Serie startenArbeitsblatt doc docx pdf Vorlesetext doc docx pdf Die Ammoniaksynthese im Modellversuch
In einigen Experimentierbüchern wird eine Synthese von Ammoniak aus den Elementen beschrieben. Mit Hilfe der Entnahmeventile an den Gasflaschen wird der Gasstrom so eingestellt, dass etwa dreimal so viel Wasserstoff wie Stickstoff zusammengemischt werden. Die Kontrolle erfolgt über die Blasenzählung in den beiden Gaswaschflaschen, in denen sich Paraffinöl befindet.
Nach einer Weile wird
an der Entnahmedüse ganz rechts an der Apparatur die Knallgas-Probe
durchgeführt. Erst wenn diese negativ verläuft, wenn also kein
Sauerstoff mehr in der Apparatur vorhanden ist, kann der austretende Wasserstoff
gezündet werden. In der nach dem Reaktionsrohr nachgeschalteten Gaswaschflasche
befindet sich eine wässrig-alkoholische Phenolphthalein-Lösung.
Nun wird der Brenner gezündet und der Katalysator im Reaktionsrohr erhitzt. Er beginnt zu glühen und allmählich färbt sich die Phenolphthalein-Lösung pink. Dies ist darauf zurückzuführen, dass im Reaktionsrohr der Stickstoff mit dem Wasserstoff am Katalysator zu Ammoniak reagiert, das sich im Wasser der nachgeschalteten Waschflasche zu Ammoniaklösung löst. Das Phenolphthalein zeigt die entstehende, alkalische Lösung an. Weitere Informationen Geschichte der Ammoniaksynthese Ammoniak Düngemittel Stickstoff Synthesegas-Erzeugung Buch individuell erstellen: Basis-Text Ammoniak und Ammoniaklösung  
> Inhaltsverzeichnis |
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen