|
Zur Geschichte des Periodischen Systems der Elemente Prof. Dr. rer. nat. Peter Buck Wer sich mit dem Periodischen
System der chemischen Elemente befassen will, tut gut daran zu wissen,
dass hierbei das Wort 'Element' in zwei völlig verschiedenen Bedeutungen
nebeneinander verwendet wird:
Einmal meint man mit
dem „Element Gold“ den gelb glänzenden, den elektrischen Strom
hervorragend
leitenden, bei 1064 °C schmelzenden und spezifisch sehr
schweren Stoff. Seine Dichte beträgt 19,32 Gramm pro
Kubikzentimeter. Und ohne Vorwarnung meint man daneben mit dem
„Element Gold“ auch das Goldatom, das gar keinen Schmelzpunkt haben kann
und auch nicht den Strom leiten, das für sich auch keine Farbe hat
in dem Sinn wie wir Farbe verstehen, sondern Farbe erst erzeugt, wenn
sehr
viele Atome zu Stoffpartikeln oder Stoffportionen zusammentreten. Dann
kann Gold rot oder grün oder gelb-glänzend sein, bei
Tageslicht
betrachtet. Die Betrachtung der elementaren
Stoffe stand im Neunzehnten Jahrhundert im Vordergrund als das
Periodensystem der
Elemente entwickelt wurde. Die Betrachtung der elementaren Atome kam
erst
im Zwanzigsten Jahrhundert in den Blick.
Moderne Periodische Systeme der Elemente enthalten Angaben über elementare Stoffe wie Siedepunkt, Schmelzpunkt, Dichte, Metall, Nichtmetall und auch Angaben zu den elementaren Atomen wie Protonenzahl, Elektronenkonfiguration oder Elektronegativität. Jeder elementare Stoff ist prinzipiell aus lauter gleichartigen Atomen aufgebaut. Kein Stoff ist ganz genau zu 100% rein; den Rekord an Reinheit hält Silicium mit 99,9999999999% Reinheit. Das heißt: Hier ist jedes billiardste Atom ein Fremd-Atom. Der Engländer Robert Boyle (1627–1691) kann als Begründer der modernen Chemie angesehen werden: Er klassifizierte als erster die Säuren als die Stoffe, die blaue Pflanzenfarbstoffextrakte rot färben, und Marmor auflösen. Basen konnten diesen Prozess rückgängig machen. Er war auch derjenige, der überzeugend darlegte, dass es nicht vier Elemente, also Wasser, Erde, Feuer und Luft, sondern sehr viel mehr Elemente geben müsste, um die Vielfalt der Stoffe zu erklären und dass man als Element diejenigen einheitlichen Stoffe bezeichnen müsse, die man auf keine Weise mehr in zwei verschiedene andere Stoffe umwandeln könne. Aus Wasser (allein) kann man ja bekanntlich Wasserstoff plus Sauerstoff gewinnen, aus Kalk gebrannten Kalk plus Kohlensäure (heutiger Name: Kohlenstoffdioxid). Aber Schwefel (allein) bleibt immer nur Schwefel, so hoch man es auch erhitzt oder so trickreich man es auch zu elektrolysieren versucht. Der Franzose Antoine Lavoisier (1743–1794) übernahm Boyles Elementdefinition (ohne ihn namentlich zu nennen), aber er hatte doch eine andere, weiterführende Vorstellung vom Element. Er unterschied 'matière' und 'principe'. Die matière tritt in Erscheinung: die matière sulfurique, die Schwefelmaterie, ist gelb und schmilzt zur gelben, später roten Flüssigkeit. Aber in der Schwefelsäure sind das principe sulfurique, das Schwefelprinzip, zusammen mit dem principe oxygènique, dem säurezeugenden Prinzip, wirksam. Das principe sulfurique verleiht der Schwefelsäure die individuellen Eigenschaften, die die Schwefelsäure ausmachen, das principe oxygènique verleiht ihr die allgemeinen Säureeigenschaften. Tabelle aus Lavoisiers Traité élémentaire de chimie, 1789 [Lit. 76] Für Lavoisier gab es keine Stoffe, in denen matière und principe zusammenfielen, denn alle Stoffe waren Verbindungen des principe calorique, weil alle Stoffe Wärme enthielten. Die Temperatur war ein Indikator für „überschüssiges“ principe calorique, beim Übergang der Aggregatzustände konnten definierte Mengen calorique aber auch chemisch gebunden werden (oder „latent“ werden). Alle Gase betrachtete Lavoisier daher als stark calorique-haltige Substanzen. Auch Schwefelsäure enthält nach Lavoisier neben dem principe oxygènique (dem „säurezeugenden“ Prinzip), welches die Stoffart bestimmt, und dem principe sulfurique, welches die Individualität dieser speziellen Säure bestimmt, zusätzlich noch das principe calorique in unterschiedlichem Maße, je nachdem wie heiß oder kalt die matière ist. Als man die sogenannten imponderablen Stoffe Wärme, Licht und Elektrizität nicht mehr als Stoffe, sondern als „Kräfte“ (Energien) ansah, der Deutsche Julius Robert Mayer (1814–1878) beansprucht für diesen Gedanken die Priorität, wurde das Problem der Stoffzusammensetzung wesentlich einfacher. Da der Engländer William Prout (1785-1850) und der Deutsche Jeremias Benjamin Richter (1762-1807) inzwischen die Gesetze der konstanten und äquivalenten Massenproportionen der Stoffe entwickelt und experimentell belegt hatten (2 Gramm Schwefel reagieren konstant mit 2 Gramm Sauerstoff zu 4 Gramm Schwefeldioxid oder konstant mit 3 Gramm Sauerstoff zu 5 Gramm Schwefeltrioxid), brach die Zeit an, in der die Chemiker in aller Welt anfingen, alle möglichen Formeln für reine Stoffe aufzustellen. Erleichtert wurde dies dadurch, dass der Schwede Jöns Jakob Bezelius (1779–1848) ein Notierungssystem mit Buchstaben für die elementaren Stoffe entwickelte. Die bisher in diesem Text genannten chemischen Reaktionen können mit seinen Formel„gleichungen“ (das = Zeichen darf nicht wie in der Mathematik gelesen werden!) so geschrieben werden: 2 H2O
= 2 H2 + O2
Die Kenntnisse über
reine Stoffe wurden immer größer, ein Ordnungssystem wurde
immer dringlicher, denn man wollte ähnliche Stoffe zusammenfassen
und deuten, wodurch die Ähnlichkeit hervorgerufen wurde. Max Pettenkofer
(1818–1901) in Deutschland, John Alexander Newlands (1838–1898) in England,
Alexandre Chancourtois (1820–1866) in Frankreich hatten solche Ordnungssysteme
entwickelt; wir können sie als Vorläufer der modernen Periodensysteme
ansehen.
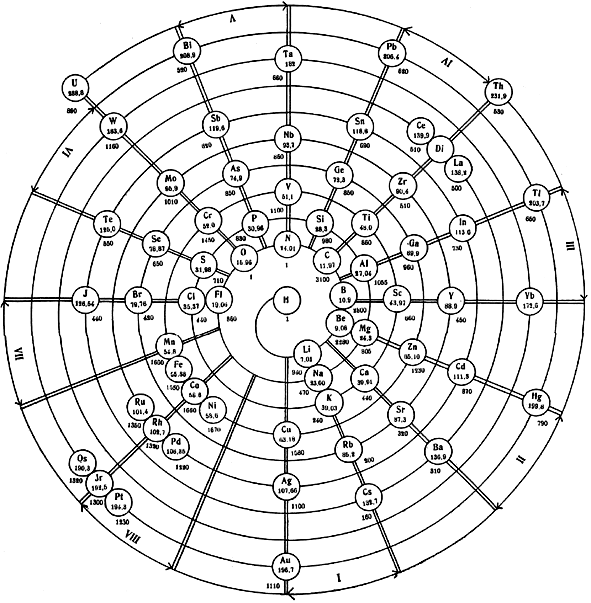
Pettenkofers spiraliges System der Elemente, aus der Studie von Julius Quaglio 1900: Zur Atom-Theorie, gewidmet an Dr. Max Pettenkofers Abhandlung von 1850 [Lit 77] Der Russe Dimitri Mendelejew (1834–1907) war der erste, der ein Periodensystem der Elemente aufstellte, das sogar noch Vorhersagen für nicht entdeckte Elemente zuließ. Mendelejew setzte sich mutig über allerlei Ungereimtheiten hinweg und forderte noch mutiger, es müsse noch unentdeckte Elemente (Germanium, Gallium und Scandium) geben, weil er in seinem System Lücken ausmachte und er könne auch ungefähr sagen, welche Eigenschaften die elementaren Stoffe und welche Formeln entsprechender Verbindungen dieser Elemente haben würden. Als tatsächlich Stoffe hergestellt wurden, die ziemlich genau auf seine Voraussagen vaus dem Jahr 1869 passten, war der Ruhm für Mendelejew natürlich gesichert.  Unabhängig von Mendelejew entwickelte auch der Deutsche Julius Lothar Meyer (1830–1895) ein sehr ähnliches Periodensystem der chemischen Elemente, eine Tabelle mit 16 Spalten [Literatur 79]. Beide, Mendelejew und Meyer, waren dazu auf dem Karlsruher Chemikerkongress von 1860 vom Italiener Stanislao Cannizzaro (1826–1910) inspiriert worden, der seinerseits eine Lanze für die atomistische Theorie seines Lehrers Amadeo Avogadro (1776–1856) brach. Thema dieses Kongresses war die Nomenklatur chemischer Verbindungen und ihre formelhafte Darstellung sowie die Frage nach den Atom- und Molekulargewichten chemischer Verbindungen. Beide, Mendelejew und Meyer, entwickelten ihre Systeme aus einer didaktischen Motivation heraus: eine Übersicht über die Fülle aller schon identifizierten und noch zu identifizierenden reinen Stoffe zu geben. In der noch tiefer gehenden Frage, ob auch die elementaren Stoffe nicht ihrerseits auf eine einzige Urmaterie, einer „proto hyle“ zurückgeführt werden könnten, waren Mendelejew und Meyer unterschiedlicher Meinung. Meyer hing der von dem Engländer William Prout entwickelten Hypothese an, alle Materie sei letzten Endes aus hochkondensiertem Wasserstoff aufgebaut, während Mendelejew ihr auf Grund von Ungereimtheiten in den Molmassen der atomaren Stoffe widersprach. Beide, Mendelejew und Meyer, konnten damals noch nicht wissen, dass im Mikrobereich der Protonen, Neutronen und Elektronen das Gesetz von der Erhaltung der Masse wegen der ins Gewicht fallenden Äquivalenz von Masse und Energie (DE = Dm × c²) nicht mehr angewendet werden darf. Die Prout’sche Hypothese hängt eng mit der Vorstellung vom atomistischen Aufbau der Materie zusammen. Die Vorstellung, es gäbe erste Aufbausteine für alle Stoffe („Atome“) stammt von Demokrit (um 460 bis 370 vor Christus). Sie wurde seitdem immer wieder diskutiert. Aber erst seitdem der Engländer John Dalton (1766–1844) damit die konstanten und äquivalenten Massen-Proportionen von Prout und Richter plausibel erklärte haben die Chemiker ein ganzes Jahrhundert lang gestritten, ob es Atome wirklich gibt. Dalton selbst sprach vom „Gesetz der konstanten und multiplen Proportionen“. Mendelejew war es egal, ob es Atome gab oder nicht (er neigte dazu, sie als bequeme Gedankenmodelle anzusehen). Der Streit hörte erst auf, als sogenannte diskrete Phänomene (Lichtblitze oder Nebelkammerspuren verursacht durch radioaktive Präparate oder die vom US-Amerikaner Robert Andrews Millikan gefundenen ganzzahligen Amplituden von schwingenden Öltröpfchen) nicht mehr anders zu deuten waren als durch die Annahme, Atome wären eben doch nicht unteilbar, sondern „aufgebaut“ aus Elementarteilchen (Proton, Elektronen, Neutronen). Hier nun setzte eine neue intensive Beschäftigung mit dem Periodensystem der Elemente ein und es war der Däne Niels Bohr (1885–1962), der als erster mit seiner Theorie des Atombaus zugleich die von Mendelejew im Prinzip schon gefundenen Struktur des Periodensystems deuten konnte. Seitdem stellt das Periodensystem der Elemente nicht nur das gängige Ordnungssystem für die Fülle der Stoffe dar, sondern darüber hinaus auch das Bildungsgesetz für die einzelnen Atomsorten. |