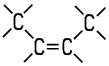|
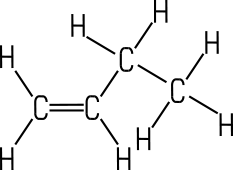 Farbloses Gas |
Molmasse 56,107 g/mol AGW keine Angaben Dichte 2,594 g/l (Gas, 0° C, 1013 hPa) (Butylen zu Luft = 2,0) Schmelzpunkt −185,33 °C Siedepunkt −6,3 °C Wasserlöslk. Konz. bei 25 °C 0,222 g/l Explosionsgrz. 1,6 bis 10 Vol.-% (Luft) Flammpunkt −80 °C Zündpunkt +385 °C |
| Piktogramme GHS 02 GHS 04 Gefahr |
Gefahrenklassen
+ Kategorie Entzündbare Gase 1 Gase unter Druck, verdicht. Gas |
HP-Sätze (siehe Hinweis) H 220, 280 P 210, 280.3, 377, 381, 410+403 Entsorgung besondere Hinweise |
| Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
|
| CAS 106-98-9 | Butylen n-Buten 1-Buten But-1-en |
Butylene n-Butene 1-Butene But-1-ene |
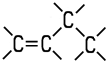
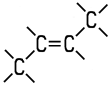
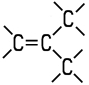
| Eigenschaften n-Buten wird auch als 1-Buten oder Butylen bezeichnet. Es ist eines der vier möglichen Isomere des Butens. Die Butene sind farblose Gase, die in höheren Konzentrationen
narkotisierend und erstickend wirken. Sie lösen sich nur in Spuren im Wasser, in Ethylalkohol
und Diethylether sind sie dagegen gut löslich. Die Butene verbrennen
mit gelber, rußender Flamme und bilden mit Luft explosionsfähige
Gemische. Als ungesättigte Kohlenwasserstoffe addieren sie aufgrund ihrer Doppelbindung gerne Wasserstoff oder Halogene an ihr Molekül. Die zwei Isomere des 2-Butens unterscheiden sich durch cis-trans-Isomerie. 2-Methyl-1-propen ist auch unter dem Namen Isobutylen bekannt. Die vier Isomere unterscheiden sich in ihren chemisch-physikalischen Eigenschaften:
|
| Herstellung Die Butene sind in der Gasfraktion bei Erdöldestillation enthalten. Daraus können sie isoliert werden. Sie entstehen auch beim thermischen
Cracken von Kohlenwasserstoffen. Eine andere Herstellungsmöglichkeit ist die Hydrierung von n-Butan oder Isobutan. |
| Verwendung Die Butene sind bedeutende Zwischenprodukte der organischen Chemie, zum Beispiel zur Herstellung von 2-Butanol, 2-Butanon oder 1,3-Butadien. Sie werden auch zur Kunststoffproduktion benötigt, beispielsweise zur Synthese von Butylkautschuk oder Polybuten. Aus den Butenen gewinnt man auch Isooctan, das als Kraftstoffzusatz zur Erhöhung der Klopffestigkeit verwendet wird. |