zur Gewinnung von Reinkupfer
Elementares Kupfer
findet sich in der Natur als Kupfer
gediegen in Form von Blechen, bäumchenartigen Formen oder Klumpen.
Diese Vorkommen reichen jedoch bei weitem nicht aus, um den Weltbedarf
zu decken. Kupfer ist jedoch in vielen Mineralien chemisch gebunden. Die
Kupfererze wie Chalkopyrit oder
Chalkosin werden bei der Kupferaufbereitung
zu Rohkupfer verarbeitet. Dieses besitzt einen Reinheitsgrad
von maximal 97%. Dies reicht für viele Anwendungen nicht aus, insbesondere
die Elektroindustrie benötigt hochreines Kupfer.
Rohkupfer mit einem Gehalt von 90 bis 95%
Bei der schmelzmetallurgischen
Raffination wird auf geschmolzenes Rohkupfer unter Zugabe von schlackenbildenden
Zusätzen Luft aufgeblasen. Dabei oxidieren bestimmte Metalle, die
als Verunreinigung enthalten sind. Die Oxide von Zink, Blei, Arsen oder
Antimon verdampfen, die Oxide von Zinn, Eisen, Cobalt oder Nickel verschlacken.
Als Ergebnis erhält man Garkupfer mit
einer Reinheit von etwa 99%. [Literatur 1]
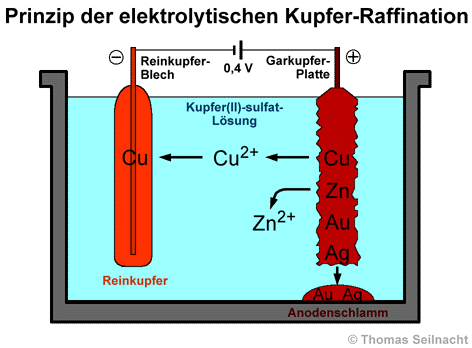
Bei der elektrolytischen Raffination hängt man 3 Zentimeter dicke Garkupfer-Platten als Anoden in eine Kupfer(II)-sulfat-Lösung, die mit verdünnter Schwefelsäure angesäuert ist. Dünne Bleche aus Reinkupfer dienen als Kathode. Die Elektrolyse findet in großen Trögen mit vielen, zusammengeschalteten Platten statt. [Literatur 5]
Bei der elektrolytischen Raffination hängt man 3 Zentimeter dicke Garkupfer-Platten als Anoden in eine Kupfer(II)-sulfat-Lösung, die mit verdünnter Schwefelsäure angesäuert ist. Dünne Bleche aus Reinkupfer dienen als Kathode. Die Elektrolyse findet in großen Trögen mit vielen, zusammengeschalteten Platten statt. [Literatur 5]
Legt man eine Spannung von
0,2 bis 0,4 Volt an, geht das Garkupfer zusammen mit allen unedleren Metallen
an der Anode in Lösung. Die Metall-Atome oxidieren dabei zu Kationen
(Cu2+, Zn2+), die in Lösung gehen. Edlere Metalle
wie Silber, Platin oder Gold, die ein positiveres Normalpotenzial
als Kupfer besitzen, oxidieren nicht und lösen sich auch nicht. Sie
fallen als Anodenschlamm an den Boden der Elektrolysezelle. Der Anodenschlamm
stellt ein wertvolles Rohmaterial zur Gewinnung von Edelmetallen und von
Halbmetallen wie Selen oder Tellur
dar. An der Kathode scheidet sich Reinkupfer
mit einer Reinheit von etwa 99,95% ab, während die unedleren Metall-Ionen
in der Lösung verbleiben.
Reaktionsgleichungen
| Oxidation an der Anode | Cu (unrein) |
| Reduktion an der Kathode | Cu2+ +
2 e− |
| Gesamtreaktion | Cu (unrein) |
An der Anode wird gleichzeitig
auch das Wasser zersetzt (Reaktion 1). Der entstehende Sauerstoff oxidiert das Kupfer
schon an der Elektrode zu Kupfer(II)-oxid (Reaktion 2):
Reaktion 1) 2 H2O
Reaktion 2) 2 Cu + O2
Die zugegebene Schwefelsäure
wandelt das unlösliche Kupfer(II)-oxid in lösliches Kupfer(II)-sulfat
um. Dadurch können die Ionen erst in Lösung gehen. [Literatur
4]
An der Kathode gewonnenes Reinkupfer
Für eine Tonne Feinkupfer
werden 250 Kilowattstunden Energie benötigt. [Literatur 2]
Es kann mehrere Monate dauern, bis die Garkupferplatten aufgelöst
sind. Kupfer ist ein wertvoller Rohstoff, der im Recycling wiedergewonnen
wird. 80 Prozent von allem jemals geförderten Kupfer ist immer noch
im Umlauf. [Literatur 6] Die
elektrochemische Raffination eignet sich auch, um andere Metalle wie Zink,
Zinn oder Chrom zu reinigen. Hierfür werden die zu reinigenden Metalle
in die entsprechende Metallsulfat-Lösung gehängt. [Literatur
3]
In einem Schulversuch kann das Prinzip der nassen, elektrochemischen Raffination leicht nachvollzogen werden: Hierzu hängt man ein kupfernes Geldstück und eine andere Münze mit einer Kupferlegierung in eine schwefelsaure Kupfer(II)-sulfat-Lösung. Die Münzen werden vorher gewogen. Dann elektrolysiert man bei einer Spannung von 3 Volt etwa 30 Minuten lang. Nach dem erneuten Wägen lässt sich feststellen, dass die Reinkupfermünze schwerer geworden ist. [leicht abgewandelt nach Literatur 4]
Literatur
In einem Schulversuch kann das Prinzip der nassen, elektrochemischen Raffination leicht nachvollzogen werden: Hierzu hängt man ein kupfernes Geldstück und eine andere Münze mit einer Kupferlegierung in eine schwefelsaure Kupfer(II)-sulfat-Lösung. Die Münzen werden vorher gewogen. Dann elektrolysiert man bei einer Spannung von 3 Volt etwa 30 Minuten lang. Nach dem erneuten Wägen lässt sich feststellen, dass die Reinkupfermünze schwerer geworden ist. [leicht abgewandelt nach Literatur 4]
Literatur
1
Hollemann/Wiberg (2007): Lehrbuch
der anorganischen Chemie, Berlin/New York
2 Binder (1999): Lexikon der chemischen Elemente, Stuttgart/Leipzig
3 Hamann/Vielstich (2005): Elektrochemie, Weinheim
4 Prof. Blume (abgerufen 12/2011) auf www.chemieunterricht.de: Kupferraffination
5 Behr/Agar/Jörissen (2010): Einführung in die Technische Chemie, Heidelberg
6 Deutsches Kupferinstitut (abgerufen auf www.kupfer-institut.de 1/2012): Kupfer, Vorkommen und Gewinnung
2 Binder (1999): Lexikon der chemischen Elemente, Stuttgart/Leipzig
3 Hamann/Vielstich (2005): Elektrochemie, Weinheim
4 Prof. Blume (abgerufen 12/2011) auf www.chemieunterricht.de: Kupferraffination
5 Behr/Agar/Jörissen (2010): Einführung in die Technische Chemie, Heidelberg
6 Deutsches Kupferinstitut (abgerufen auf www.kupfer-institut.de 1/2012): Kupfer, Vorkommen und Gewinnung