| pH-Indikatoren | ||||
|
Ein pH-Indikator ist ein Farbstoff, der durch eine Farbänderung anzeigen kann, ob eine wässrige Lösung sauer oder alkalisch reagiert. Beispiele für Indikatoren aus dem Haushalt sind Blaukrautsaft oder Schwarztee. Blaukraut wechselt seine Farbe nach Rot sobald Säuren hinzukommen, mit Laugen schlägt die Farbe nach Blaugrün um. Stark alkalische Lösungen können den Blaukraut-Farbstoff zerstören, so dass die Lösung gelb wird.
Der Lackmustest war früher im Labor die gebräuchlichste
Methode, um Säuren oder Laugen zu bestimmen. Lackmus wird aus Flechten gewonnen. Er wechselt seine
Farbe zwischen pH=5 und pH=8 von Rot nach Blau, bei pH=7 ist er
violett. Indikatoren werden im
chemischen Labor oft benutzt. Als Farbstoffe eignen sich zum Beispiel auch
Methylorange, Bromthymolblau
oder Phenolphthalein. Sie zeigen in wässriger Lösung verschiedene Farben in
Abhängigkeit vom pH-Wert:
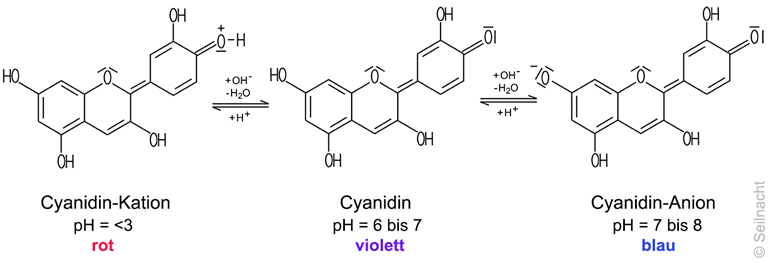
Der Farbstoff im
Blaukraut aus der Gruppe der Anthocyane wird als Cyanidin bezeichnet. Ein Indikator wie Cyanidin kann in wässriger Lösung als Brönsted-Säure oder als Brönsted-Base
wirken. Bei pH=6 bis pH=7 zeigt das Cyanidin eine violette Farbe. Bei
niedrigeren pH-Werten nimmt das Cyanidin-Molekül ein Proton auf,
dabei entsteht ein Cyanidin-Kation,
bei pH=3 zeigt dieses die rote Farbe. Bei pH=7 bis pH=8 gibt das
Cyanidin-Molekül ein Proton ab: Das Cyanidin-Anion zeigt eine blaue
Farbe. Oberhalb pH=8 entsteht durch Abgabe eines zweiten Protons sogar ein Dianion, das eine grüne Farbe zeigt.
Die roten Rosenblüten oder die blauen Blüten der Kornblume besitzen den gleichen Farbstoff. Allerdings kommt dort die unterschiedliche Farbe nicht durch den pH-Wert im Boden zustande. In den Kornblumen ist der Farbstoff noch mit anderen Ionen wie Fe3+ oder Al3+ chemisch gebunden. Dadurch entsteht ein Komplex mit einer neuen Farbe. Gärtner nutzen dieses Wissen zur Erzeugung verschiedener Farben bei den Hortensien: Gießen sie die Pflanzen während der Blütenentwicklung mit Aluminium- oder Eisensalzen, dann werden die Blüten nicht rot, sondern blau. Der gleiche Effekt wird durch das Vergraben von rostigen Nägeln im Wurzelbereich der Pflanzen erzeugt. Weitere Informationen Experimente mit Trockeneis pH-Wert Buch individuell erstellen: Basis-Text pH-Indikatoren   > Inhaltsverzeichnis |