| Titration und Maßanalyse |
|
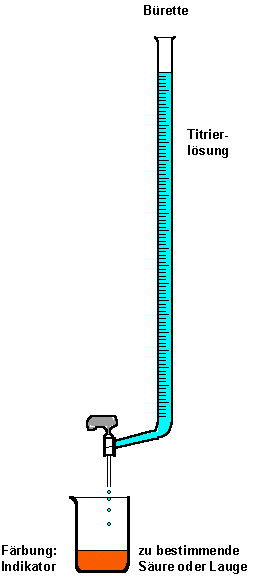
Bei einer Titration benutzt man die Eigenschaft, dass sich Säuren und Basen gegenseitig neutralisieren. Das wichtigste Arbeitsgerät bei einer Titration ist die Bürette. Die lang gestreckte Glassäule wird mit einer Maßlösung oder der Titrierlösung gefüllt. Oft ist das eine Säure oder eine Lauge, von der die genaue Konzentration bekannt ist. Nun tropft man die Maßlösung
zu der Probelösung mit unbekannter Konzentration in Portionen solange
hinzu, bis der beigefügte Indikator umschlägt. Der Farbumschlag des Indikators findet am Äquivalenzpunkt statt. Dieser Begriff wird manchmal auch Equivalenzpunkt oder kurz EP nach dem englischen equivalence point genannt. Reagiert die Lösung bei pH=7 neutral, dann ist der Neutralisationspunkt erreicht.
Bei der Neutralisation
von gleich starken Säuren und Basen wie in unserem Beispiel entspricht der Äquivalenzpunkt dem Neutralisationspunkt.
Die Durchführung der Titration erfordert viel Fingerspitzengefühl.
So muss nach der Zugabe von jedem Tropfen Maßlösung die Probelösung
umgeschwenkt werden. Wird ein Tropfen zu viel hinzugegeben, ist der Äquivalenzpunkt schnell
überschritten, dies ist beim Foto oben passiert. Beim Äquivalenzpunkt liest man die verbrauchte
Menge der Maßlösung ab. Nun kann man mit Hilfe der Tabellen oder
durch eine mathematische Berechnung die Konzentration der Probelösung
bestimmen.
 Soll die Konzentration einer unbekannten Lösung mit Hilfe einer Titration mathematisch berechnet werden, benötigt man Kenntnisse über chemische Größen wie die Stoffmenge und der molaren Masse. Moderne Büretten besitzen an der Rückwand einen Schellbachstreifen, der aufgrund einer Lichtbrechung an der Oberfläche des Flüssigkeitsspiegels schmaler erscheint und somit eine sehr genaue Ablesung ermöglicht. Moderne Titratoren ermöglichen eine automatisierte Titration Moderne Titratoren bestehen aus einer Titrationseinheit, zwei Vorratsbehältern und einem Computer. Über ein Schlauchsystem wird die Titrationseinheit automatisch mit der Probelösung und der Maßlösung gespeist. Die Elektrode der Titrationseinheit misst eine Spannung (siehe auch pH-Messgerät), die vom Computer in den pH-Wert umgerechnet wird. Der Rührer sorgt für eine gleichmäßige Durchmischung der Lösung. Die Titration wird durch die Start-Taste am Computer in Gang gesetzt. Zunächst wird eine bestimmte Portion der Probelösung aus dem hinteren Vorratsgefäß vorgelegt, dann erfolgt die schrittweise Zugabe der Maßlösung (aus dem vorderen Behälter). Am Ende der automatisch ablaufenden Titration kann man über den Bildschirm am Computer eine Messwert-Tabelle oder eine Titrationskurve anzeigen lassen. Der Umschlagspunkt kann wie bei einer manuellen Titration durch den Farbumschlag in der Flüssigkeit erkannt werden. Allerdings ist nur die rechnerische Auswertung der Daten durch den Computer zuverlässig. Der Computer druckt eine Titrationskurve aus, auf der der Äquivalenzpunkt (EP) markiert ist. 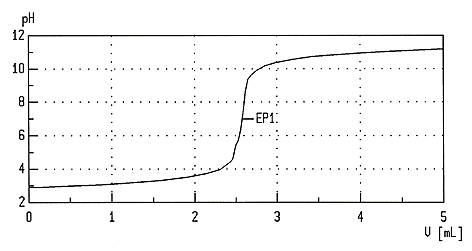 Beispiel: Auf
der y-Achse wird in dieser Titrationskurve die verbrauchte Menge an
Maßlösung
(im Beispiel Salzsäure 0,1 mol/l) angegeben. Der Titrator gab bis
zum Äquivalenzpunkt (EP1) 2,5 ml Salzsäure mit der
Konzentration 0,1 mol/l
hinzu. Es wurden vorher 2,5 ml Natronlauge mit einer unbekannten
Konzentration
als Probelösung vorgelegt. Da die gleiche Menge an
Maßlösung
wie Probelösung bis zum Erreichen des EP verbraucht wurde, muss die
Konzentration der Natronlauge gleich sein wie die der Salzsäure.
Maßanalyse Bei einer Maßanalyse
wird aus dem Verbrauch eines Stoffes (bei der Reaktion mit dem zu bestimmenden
Stoff) die Menge des zu bestimmenden Stoffes ermittelt. Die Maßlösung
mit der bekannten Konzentration wird auch als Titer
(oder Titrierlösung) bezeichnet. Es werden in der Regel Normal-Lösungen
verwendet (zum Beispiel 0,1 mol/l oder 0,01 mol/l). Die maßanalytischen Verfahren
lassen sich in drei Methoden unterteilen: a) Bei Titrationen erkennt
man den Umschlagspunkt durch die Zugabe von Indikatoren oder durch die
Messung der Leitfähigkeit.
Buch individuell erstellen: Basis-Text Titration   > Inhaltsverzeichnis |