 |
Weißes, kristallines Pulver |
Molmasse 65,010 g/mol AGW 0,2 mg/m3 (TRGS 900) Zersetzung +300°C Dichte 1,846 g/cm3 Wasserlöslichkeit 100g H2O lösen bei 20 °C 40,8 g |
| Piktogramme GHS 06 GHS 08 GHS 09 Gefahr |
Gefahrenklassen
+ Kategorie Akute Toxizität oral und inhalativ 2 Akute Toxizität dermal 1 Spez. Zielorgantox. w. 2 (Gehirn) Gewässergef. akut/chronisch 1 |
HP-Sätze (siehe Hinweis) H 300, 310, 330, 373 (Gehirn), 400, 410, EUH032 P 273, 280.1-4,6+7, 301+310+330, 302+352, 310, 391 Entsorgung besondere Hinweise |
| Deutscher Name | Englischer Name | |
| CAS 26628-22-8 | Natriumazid | Sodium azide |
| Eigenschaften Das Natriumsalz der Stickstoffwasserstoffsäure HN3 bildet
farblose Kristalle, die im kristallinen Pulver weiß erscheinen.
Sie sind gut im Wasser löslich. In Ethylalkohol sind sie nur wenig
löslich und in Diethylether gar nicht. In sauren Azidlösungen
wird Stickstoffwasserstoffsäure gebildet, die schon beim Schütteln explodieren kann.
Beim Erhitzen über 300 °C zerfällt Natriumazid in Natrium
und Stickstoff. Mit Schwermetallsalzen bilden sich in wässriger
Lösung Schwermetallazide, die alle temperatur- und druckempfindlich
sind. Sie explodieren bei Erwärmung oder bei Druckausübung.
Eine Explosion kann schon auftreten, wenn sich große Kristalle
bilden, die zerbrechen.
2 NaN3 + Pb(NO3)2 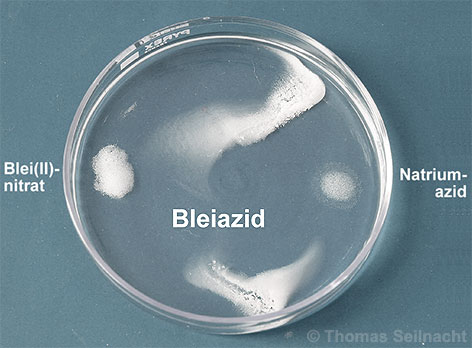 Natriumazid reagiert in wässriger Lösung mit Blei(II)-nitrat zu Bleiazid. Hinzugefügtes Dextrin verhindert die Ausbildung großer Kristalle. Diese Demonstration ist für Schulen nicht geeginet. >Film |
| Herstellung Eine Möglichkeit zur Herstellung wäre das Zusammenschmelzen von Natriumamid mit Natriumnitrat. In
der chemischen Industrie wird Natriumazid durch das Erhitzen von
Natriumamid mit Distickstoffoxid bei 180 bis 190 °C gewonnen:
2 NaNH2 + N2O |
| Verwendung In der analytischen Chemie dient Natriumazid als Reagenz zum Nachweis von Sulfid-Ionen oder von organisch gebundenem Schwefel, beispielsweise in Thioalkoholen. Eine wässrige Natriumazidlösung und eine Iodlösung werden zusammengegeben: Bei der Zugabe einer schwefelhaltigen, organischen Substanz entfärbt sich die Lösung relativ schnell. Die Reaktion beruht auf der Reduktion von Iod zu Iodid-Ionen durch die Azid-Ionen. Beim Vorhandensein von Schwefel wird diese Reaktion stark beschleunigt: I2 + 2 N3− Natriumazid ist in der chemischen Industrie ein Zwischenprodukt zur Herstellung anderer Azide wie Bleiazid oder Silberazid. Diese eignen sich als Initialsprengstoff in Patronen oder in Detonationszündern. Auch zur Produktion von organischen Aziden wie Tosylazid, von Aminen, Amiden oder Isocyanaten wird Natriumazid benötigt. Bis Mitte der 1990er-Jahre wurde Natriumazid in den Airbags für Autos verwendet. |