|
Hellgrüne Kristalle |
Molmasse (Hexahydrat) 392,139 g/mol AGW keine Angaben Dichte (Hexahydrat) 1,86 g/cm3 Kristallwasserabgabe +100 °C Wasserlöslichkeit (Hexahydrat) 100 g Wasser lösen bei 20°C 26,9 g |
| - | - | Entsorgung G 4 |
| Etikett drucken | Deutscher Name | Englischer Name |
| CAS 100-45-89-3 |
Ammoniumeisen(II)-sulfat | Ammonium iron(II) sulfate |
| CAS 7783-85-9 | Ammoniumeisen(II)-sulfat Hexahydrat Mohrsches Salz *) |
Ammonium iron(II) sulfate hexahydrate Mohr's salt |
*) Für die Schule bevorzugt.
| Eigenschaften Ammoniumeisen(II)-sulfat
wird hauptsächlich als Hexahydrat verwendet. Die hellgrünen
Kristalle sind sehr gut in Wasser löslich und bilden eine saure
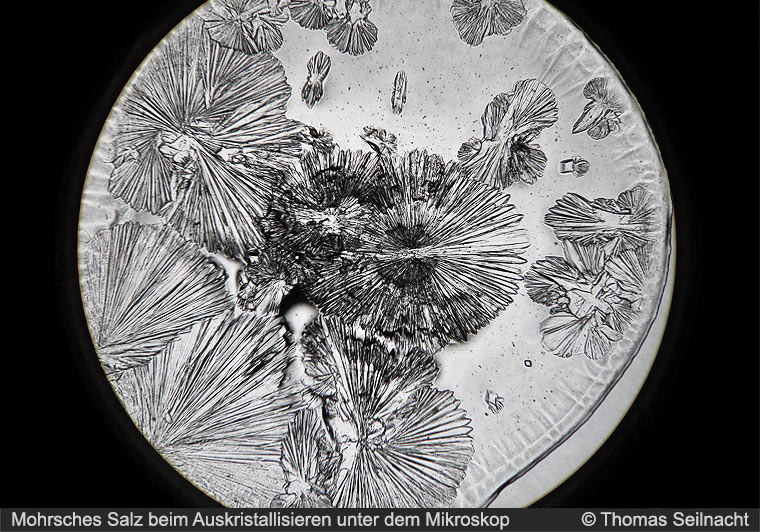
Lösung. Sie kristallisieren nach dem monoklinen System. Das Salz mit den zwei verschiedenen Kationen Fe2+ und NH4+ gehört zu den Doppelsalzen. Beim Lösen im Wasser entsteht ein Eisen-Wasser-Komplex [Fe(H2O)6]2+, der besonders stabil ist. Das zentrale Fe2+-Ion ist im Komplex von sechs Wasser-Molekülen als Liganden umgeben. Der unter dem Namen Mohrsches Salz bekannte Stoff ist nach dem deutschen Chemiker Karl Friedrich Mohr (1806–1879) benannt.
 Mohrsches Salz bildet monokline Kristalle. |
| Herstellung Nach dem Mischen
zweier heißgesättigter Lösungen von Eisen(II)-sulfat und
Ammoniumsulfat mit wenig Schwefelsäure kristallisiert nach dem
Abkühlen das Mohrsche Salz aus.
(NH4)2SO4 + FeSO4 |