 |
 Weißes, kristallines Pulver |
Molmasse 116,119 g/mol AGW keine Angaben Dichte keine Angaben Schmelzpunkt +245,5 °C Sublimation +234 °C Wasserlöslichkeit Konz. bei 20°C 0,6 g/l |
| Piktogramme GHS 02 Achtung |
Gefahrenklassen
+ Kategorie Entzündbare Feststoffe 2 |
HP-Sätze (siehe auch Hinweis) H 228 P 210, 280.3, 370+378 Entsorgung G 3 |
| Etikett drucken | Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
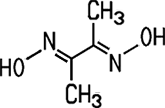
| CAS 95-45-4 | Dimethylglyoxim Diacetyldioxim 2,3-Butandiondioxim |
Dimethylglyoxime Diacetyl dioxime 2,3-Butanedione dioxime |
| Eigenschaften Dimethylglyoxim
ist im Chemikalienhandel als weißes, kristallines Pulver
erhältlich. Es ist nur wenig löslich in Wasser. In
Ethylalkohol und Diethylether löst es sich gut. Dimethylglyoxim
bildet mit Schwermetall-Ionen wie Ni2+, Fe2+, Co2+, Cu2+, Pt2+ oder Pd2+ farbige Komplexe.  |
| Herstellung Die Herstellung von Dimethylglyoxim erfolgt aus 2,3-Butandion, das mit Hydroxylamin umgesetzt wird. |
| Verwendung Dimethylglyoxim oder Tschugaeffs
Reagenz ist eine wichtige Reagenz zum Nachweis
der Nickel(II)-Ionen. Verwendet wird eine alkoholische Lösung, die
mit Nickel(II)-salzen einen himbeerroten, unlöslichen Komplex bildet. Der Nachweis ist so empfindlich, dass man sogar Nickel-Ionen
auf Münzen nachweisen kann, die bei der Berührung von
nickelhaltigen Münzen mit der Säureschutzschicht der Haut
entstehen. Mit Kupfer(II)-Ionen bildet sich ein brauner Komplex, mit
Cobalt(II)-Ionen ein violetter Komplex, mit Eisen(II)-Ionen ein roter
Komplex und mit Platin(II)-Ionen ein brauner oder blauer Komplex.  Bei der Reaktion von Dimethylglyoxim mit Nickel(II)-Ionen entsteht ein Nickel-Dimethylglyoxim-Komplex. |