 |
 Blassgelbe, orthorhombische Kristallnadeln Vorkommen Mineral Hoelit |
Molmasse 208,213 g/mol AGW entfällt (krebserzeugender Stoff) Dichte 1,438 g/cm3 Schmelzpunkt +284,8 °C Siedepunkt +377 °C Wasserlöslichkeit Konz. bei 25 °C 1,4 mg/l Explosionsgrz. keine Angaben Flammpunkt +185 °C Zündpunkt +450 °C |
| Piktogramme GHS 08 Gefahr |
Gefahrenklassen
+ Kategorie Karzinogenität 1B |
HP-Sätze (siehe auch Hinweis) H 350 P 201, 280.1-3+7, 308+313 Entsorgung G 1 |
| Etikett drucken | Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
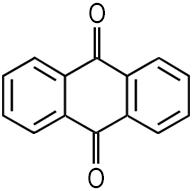
| CAS 84-65-1 | Anthrachinon 9,10-Anthracendion |
Anthraquinon 9,10-Anthracenedione |
|
Bemerkungen
für Schulen: Anthrachinon ist seit 2017 als krebserzeugender Stoff
der Kategorie 1B eingestuft. Er hat im Tierversuch Krebs in der
Leber und in den Nieren verursacht. Eine Verwendung an deutschen Schulen ist nicht
erlaubt. Es wird vom Autor auch für die Schweiz und andere Länder empfohlen, diesen Stoff an Schulen nicht auzubewahren.
Eigenschaften Anthrachinon
bildet blassgelbe Kristallnadeln, die nach dem orthorhombischen System
kristallisieren. Sie lösen sich nur in Spuren im Wasser und sind
auch in organischen Lösungsmitteln bei Raumtemperatur kaum
löslich. In siedendem Benzol sind sie gut löslich.
Anthrachinon ist nur schwer oxidierbar. Mit Reduktionsmitteln wie Natriumdithionit
bildet sich in Natronlauge eine rote Küpe, dessen Färbung
durch das lösliche Natriumsalz des Anthrahydrochinons verursacht
wird. An der Luft erfolgt wieder eine Entfärbung.  |
| Herstellung Anthrachinon kann durch die Oxidation von Anthracen mit Natriumdichromat und verdünnter Schwefelsäure
oder Eisessig gewonnen werden. Eine andere Herstellungsmöglichkeit
ist die Reaktion von Phthalsäureanhydrid mit Benzol in Gegenwart
von Aluminiumchlorid. Die entstehende o-Benzoylbenzoesäure wird mit
Schwefelsäure unter Wasserabspaltung zum Anthrachinon umgesetzt.
|
| Verwendung Anthrachinon
ist ein bedeutendes Zwischenprodukt zur Herstellung der Indanthren-
oder Anthrachinon-Farbstoffe. Zu letzteren zählen zum Beispiel
Brillantblau oder Alizarin. Beim Anthrachinon-Verfahren wird Luftsauerstoff unter Einsatz von Anthrahydrochinon zu Wasserstoffperoxid hydriert.
Das hierbei entstehende Anthrachinon wird mit Hilfe von Katalysatoren
und Wasserstoff wieder zu Anthrahydrochinon reduziert,
damit es erneut verwendet werden kann. Der Einsatz von Anthrachinon zum Schutz der Saat als Abwehrmittel gegen Vögel ist in der EU nicht mehr zugelassen. Produkte aus anderen Ländern können aber den Stoff enthalten: Bei manchen Schwarztee-Sorten wurde er gelegentlich in Spuren nachgewiesen. |