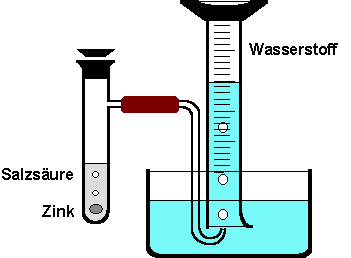
Ein
Reagenzglas wird zur Hälfte mit verdünnter Salzsäure der Konzentration 1 Mol pro Liter gefüllt. Bei der Zugabe von Zink-Stückchen
entsteht in einer lebhaften Reaktion Wasserstoff,
den man pneumatisch in einem Messzylinder auffängt. Für die Reaktion
wird folgende Reaktionsgleichung angegeben:
2 HCl + Zn
Im ersten Experiment
wird das Volumen genau nach einer Minute abgelesen, die Zink-Stückchen
entnommen und die Konzentration der verbleibenden Säure bestimmt.
Im zweiten Experiment verfährt man genau gleich und führt die
Messungen nach zwei Minuten durch, usw. Die Ergebnisse werden in einer Tabelle
eingetragen:
| Experiment | Start | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Zeit (Minuten) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Konzentration HCl (Mol pro Liter) | 1 | 0,8 | 0,6 | 0,42 | 0,28 | 0,18 | 0,11 | 0,07 | 0,04 | 0,02 | 0 |
| Gasvolumen H2 (Milliliter) | 0 | 10 | 20 | 30 | 40 | 47 | 50 | 52 | 53 | 54 | 55 |
Das Ablaufen dieser chemischen
Reaktion hängt von der Reaktionsgeschwindigkeit v ab. Darunter versteht
man die Änderung der Konzentration an Ausgangs-Stoffen (oder an Produkten)
pro Zeitspanne, in der diese Änderung eintritt:
v = Δc ÷ Δt
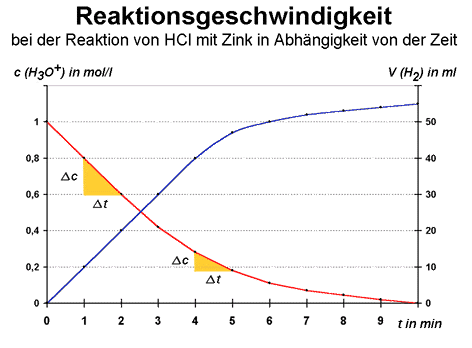
Beim ersten Experiment nahm die Konzentration der Salzsäure in einer Minute um 0,2 Mol pro Liter ab.
Somit ergibt sich für den Ausgangs-Stoff (HCl) diese Reaktionsgeschwindigkeit:
v = 0,2 mol/l ÷ 60 s = 0,0333 mol/l s
Misst man weitere Zeitintervalle, stellt man fest, dass die Reaktionsgeschwindigkeit allmählich abnimmt. Dies hängt mit der Abnahme der Konzentration der Salzsäure zusammen, am Ende der Reaktion bildet sich auch immer weniger Wasserstoff pro Zeiteinheit. Als Beispiel wird die Reaktionsgeschwindigkeit zwischen dem Zeit-Intervall nach vier bis fünf Minuten bestimmt:
v = 0,1 mol/l ÷ 60 s = 0,0166 mol/l s
Die Reaktionsgeschwindigkeit ist nun nur noch halb so groß. Dies wird auch auf der folgenden Grafik verdeutlicht. Die Abnahme der Reaktionsgeschwindigkeit kann an der abnehmenden Steilheit der absteigenden Kurve abgelesen werden:
v = 0,2 mol/l ÷ 60 s = 0,0333 mol/l s
Misst man weitere Zeitintervalle, stellt man fest, dass die Reaktionsgeschwindigkeit allmählich abnimmt. Dies hängt mit der Abnahme der Konzentration der Salzsäure zusammen, am Ende der Reaktion bildet sich auch immer weniger Wasserstoff pro Zeiteinheit. Als Beispiel wird die Reaktionsgeschwindigkeit zwischen dem Zeit-Intervall nach vier bis fünf Minuten bestimmt:
v = 0,1 mol/l ÷ 60 s = 0,0166 mol/l s
Die Reaktionsgeschwindigkeit ist nun nur noch halb so groß. Dies wird auch auf der folgenden Grafik verdeutlicht. Die Abnahme der Reaktionsgeschwindigkeit kann an der abnehmenden Steilheit der absteigenden Kurve abgelesen werden:
Führt man das obige
Experiment mit konzentrierter Salzsäure durch, dann entsteht
mehr Wasserstoff in einer kürzeren Zeit-Einheit, die Konzentration
der Salzsäure nimmt schneller ab, die Reaktionsgeschwindigkeit erhöht
sich. Dieser Effekt wird auch mit einer Temperatur-Erhöhung erreicht.
Dabei gilt die Faustregel: Bei einer Erhöhung der Temperatur um 10
Kelvin (10 °C) steigt die Reaktionsgeschwindigkeit mindestens um das
Doppelte. Verwendet man statt Zinkstücke pulverförmiges Zink,
ist ebenfalls eine erhöhte Gasentwicklung sichtbar. Dies lässt
sich in einem Versuch jedoch nur mit frisch reduziertem Zink zeigen. Je
größer die Oberfläche und je größer der Zerteilungsgrad
der Reaktionspartner ist, umso größer ist auch die Reaktionsgeschwindigkeit.
Bestimmte Faktoren begünstigen also die Reaktionsgeschwindigkeit:
-
Erhöhung der Konzentration der reagierenden Stoffe
-
Temperaturerhöhung
-
Feinere Zerteilung und Erhöhung der wirksamen Oberfläche
Buch individuell erstellen: Basis-Text Reaktionsgeschwindigkeit


> Inhaltsverzeichnis