Nur für Lehrkräfte geeignet, Empfehlung: Auf Versuche mit Chlor und Brom verzichten!
Inhalt
Didaktische Bemerkungen Demonstration 1: Chlor herstellen Demonstration 2: Bleichwirkung des Chlors Demonstration 3: Brom verdampfen Demonstration 4: Iod sublimieren und resublimieren Demonstration 5: Chlor reagiert mit Natrium Demonstration 6: Chlor reagiert mit Eisenwolle Demonstration 7: Brom reagiert mit Aluminiumfolie Demonstration 8: Magnesium reagiert mit Iod Demonstration 9: Eigenschaften der Halogenide Die Versuche werden beschrieben, da sie in elementaren Versuchen die
Eigenschaften der Halogene verdeutlichen. Wie bei den Versuchen
mit den Alkalimetallen werden bei den Halogenen als Elementfamilie der 17. Gruppe im Periodensystem Verwandtschaften und
Ordnungskriterien im PSE deutlich. Es treten ähnliche Stoffeigenschaften
auf, die aber von Element zu Element variieren. Reagieren Halogene mit
Alkalimetallen (oder anderen Metallen), entstehen Ionenbindungen.
Die gebildeten Salze kommen in der Natur
als Mineralien in großer Vielfalt vor. Das hohe Reaktionsverhalten
der Halogene lässt sich auch damit erklären, dass die Atome der
Halogene 7 Valenzelektronen in der äußeren Schale besitzen und daher nur noch ein Elektron
zum Erreichen der Edelgaskonfiguration benötigen.
**) Werte geschätzt Hinweise:
Beim Arbeiten mit Chlor ist höchste Vorsicht geboten. Alle Demonstrationen mit Chlor dürfen
nur in einem vollständig geschlossenen Abzug durchgeführt werden.
Entspricht die vorliegende Anlage nicht den Vorschriften beim Arbeiten
mit Chlor, können die hier beschriebenen Versuche nicht vorgeführt
werden. Chlor ist ein sehr giftiges
Gas. Luft, die 0,5 bis 1% Chlorgas enthält, wirkt auf den Menschen rasch
tödlich. Chlor wirkt ätzend auf die Schleimhäute, da in
der Lunge und auf den feuchten Schleimhäuten Chlorwasserstoff und damit auch Salzsäure gebildet
wird. Es ist selbst in einer Verdünnung von 1 zu 100000 noch bemerkbar.
Beim Arbeiten mit Chlor in der Schule kann ein vollständiger Schutz
nicht immer gewährleistet werden, da das Gas schwerer als Luft ist
und unter Umständen auch aus dem Abzug herausfließt. Es wird empfohlen, diesen Versuch nicht durchzuführen und einen Film zu zeigen:
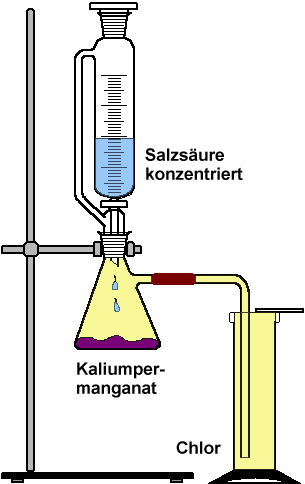
Die nachfolgende Beschreibung ist keine Anleitung zur Durchführung, sondern sie dient lediglich zur Unterstützung des Films: Ein Gasentwickler wird im Abzug aufgebaut. In den Erlenmeyerkolben gibt man 3 gehäufte Löffel Kaliumpermanganat und setzt dann den Tropftrichter auf. Dieser wird mit 50 ml konzentrierter Salzsäure gefüllt. Die seitliche Ableitung ist mit einem Winkelrohr verbunden, das tief in einen Standzylinder taucht, dessen Boden mit Quarzsand bedeckt ist. Nun öffnet man vorsichtig den Hahn und lässt die Salzsäure langsam auf das Kaliumpermanganat tropfen. Auf diese Weise füllt man mehrere Standzylinder mit Chlorgas und deckt sie mit einer runden Glasscheibe ab. Bemerkungen: Bei höheren Temperaturen entsteht bei dieser Reaktion auch noch Sauerstoff. Um das zu verhindern, müsste der Reaktionskolben von außen mit Eis gekühlt werden. Zur Reinigung wird das entstehende Chlor nacheinander durch zwei Gaswaschflaschen geleitet: Die erste enthält konzentrierte Kaliumpermanganat-Lösung und die zweite konzentrierte Schwefelsäure. Bei diesem Aufbau besteht allerdings die Gefahr, dass die Flüssigkeiten in den Reaktionskolben zurückgedrückt werden und Chlor aus dem Tropftrichter entweicht. Chlor lässt sich mit Aktivkohle oder mit Natriumthiosulfat-Lösung absorbieren.
Beobachtungen:
Beim Tropfen der Salzsäure auf das
Kaliumpermanganat entsteht ein gelbgrünes Gas, das sich im Standzylinder
sammelt. Das kurzzeitige Abheben der Glasplatte führt zu keinem nennenswerten
Gasverlust.
Theorie: Bei der Reaktion von Salzsäure mit Kaliumpermanganat entsteht Chlor in einer relativ komplizierten Reaktion: 2 KMnO4
+ 16 HCl
Chlor ist sehr giftig, es besitzt eine Dichte von 3,214 Gramm pro Liter und ist damit fast dreimal so schwer als Luft. Ergänzende Informationen: Chlorgas wurde im 1. Weltkrieg erstmals als Kampfgas eingesetzt. Der Nobelpreisträger Fritz Haber (1868–1934) entwickelte eine Technik, bei der chlorgefüllte Stahlflaschen mit Steigrohren an der französischen Front eingegraben wurden. Kam der Wind von hinten, wurden die Flaschen geöffnet und das Chlor blies in einer weißlichen bis gelbgrünen Wolke in Richtung der gegnerischen Linien. Aufgrund seiner höheren Dichte kroch das Giftgas in die feindlichen Schützengräben und richtete dort verheerende Wirkungen an. Fritz Haber selbst begutachtete an der Front die Wirkung des Gasangriffes in Ypern am 22. April 1915. Seine Frau Clara Immerwahr, ebenfalls eine bedeutende Chemikerin, erschoss sich zehn Tage später. Ihr Selbstmord wird mit den schrecklichen Folgen in Verbindung gebracht, die ihr Mann mit verschuldet hatte. „Der französische
Brigadegeneral Jean Henry Mordacq (...) ritt mit einigen Soldaten in Richtung
Front. In der Nähe des Ypernkanals bemerkten sie heftiges Ohrensausen
sowie ein Kratzen in der Kehle. Zunehmend traten auch Atembeschwerden auf.
Als dann selbst die Pferde bockten, ging es zu Fuß weiter. Am Kanal
kamen ihnen die ersten flüchtenden Soldaten entgegen, die ihre Waffen
weggeworfen hatten und mit weit geöffneten Uniformen wie Irrsinnige
nach hinten eilten. Sie schrien laut nach Wasser, spuckten Blut. Einige
wälzten sich am Boden und rangen vergeblich nach Luft.“ (nach: J.H.
Mordacq: Le Drame de l'Yser, Paris 1933, in: Dieter Martinetz, Der Gaskrieg
1914-1918, Bonn 1996)
Über die Zahl der Toten und Verletzten des ersten Gasangriffs der Geschichte existieren widersprüchliche Angaben. Während manche Quellen von nur wenigen Toten berichteten, gingen andere Schätzungen von bis zu 3000 Toten und 7000 Vergiftungsfällen aus. Weitere Infos finden sich bei Fritz Haber und die Entwicklung chemischer Waffen). Man zeigt den Schülerinnen und Schülern eine Packung Toilettenpapier oder Papier-Taschentücher, die mit dem Aufdruck „chlorfrei gebleicht“ versehen sind. Sie werden befragt, was der Aufdruck bedeutet. Manche haben sich die Bedeutung vielleicht schon einmal überlegt. Rohe, unbehandelte Holzfasern haben einen bräunlichen bis gelblichen Farbton. Um ganz weißes Papier zu erhalten, müssen die Holzfasern gebleicht werden. Wird dabei Chlor verwendet, entstehen erhebliche Umweltprobleme (siehe >Chemie im Haushalt). Bei chlorfrei gebleichtem Papier wird mit Sauerstoff gebleicht, der beim Einsatz des harmloseren Wasserstoffperoxids entsteht. Zum Bleichen wird ein gefärbtes Stück Stoff mit einer Tiegelzange in einen mit Chlorgas gefüllten Standzylinder gehalten. Das Eintauchen einer roten Rose oder einer roten Nelke bewirkt den gleichen Effekt. Es wird empfohlen, auf dieses Experiment zu verzichten und stattdessen Fotos oder einen Film zu zeigen: Theorie:
Das sehr reaktionsfreudige Chlor zerstört die Farbstoffe. In seiner Reaktionsfähigkeit wird es
nur noch vom Fluor übertroffen.
Chlor reagiert mit vorhandener Feuchtigkeit zu Chlorwasserstoff und atomarem Sauerstoff, der die Farbstoffe oxidiert:
Cl2 +
H2O
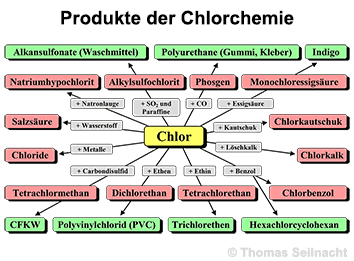
Im Schwimmbad dient Chlor zur Entkeimung des Wassers, da es Pilze und Bakterien abtötet. Es ist bereits in einer Konzentration 0,3 Milligramm pro Liter Wasser wahrnehmbar. Bereits diese Konzentration kann zu Augen- und Schleimhautreizungen führen. Chloriertes Trinkwasser enthält Chlor in noch geringeren Konzentrationen. Chlor ist ein wichtiges Zwischenprodukt zur Herstellung zahlreicher Stoffe. Dazu gehören Salzsäure und sämtliche Chloride wie Eisenchlorid, Natriumchlorid oder Silberchlorid. Die Grafik rechts verdeutlicht die Bedeutung des Chlors in der chemischen Industrie:
Hinweise: Brom und
vor allem seine Dämpfe sind noch toxischer als Chlor. Daher gilt
ebenfalls die höchste Sicherheitsstufe. Gelangt flüssiges Brom
auf die Haut, entstehen tiefe Verätzungen mit schwer heilenden Wunden. Abzug, Schutzbrille und Schutzhandschuhe sind unbedingt notwendig. Eine
besondere Gefahr für die Hände geht von den früher verwendeten
Doppelkappenflaschen aus, da sich dort verdampftes und wieder kondensiertes
Brom (Siedepunkt: +58,78 °C) im äußeren Kappenrand sammeln
kann. Das Umfallen einer mit Brom gefüllten
Flasche im Unterrichtsraum hat schon öfters zu Chemieunfällen
an Schulen geführt. Daher wird empfohlen, auf Experimente mit
Brom an den Schulen ganz zu verzichten und Filme einzusetzen:
Durchführung: Mit einer Sicherheitspipette werden etwa 1 ml Brom aus der Flasche entnommen und in einen Standzylinder getropft. Alternativ kann auch eine große Glaswanne verwendet werden.
Beobachtungen:
Langsam verdampft das flüssige Brom schon
bei Zimmertemperatur, wobei sich rotbraune Dämpfe im Gefäß
verbreiten.
Iod und Iod-Dämpfe sind nicht ganz so gefährlich wie Chlor und Brom, trotzdem sollten die Dämpfe nicht eingeatmet werden. Iod wirkt gesundheitsschädlich beim Einatmen und bei Berührung, und es schädigt die Schilddrüse. Wenn das System nicht vollständig geschlossen ist, muss der Versuch in einem Abzug durchgeführt werden. Schutzbrille und Schutzhandschuhe sind notwendig. Iod wirkt keimtötend und wird als Ersatzstoff zum Desinfizieren von Schwimmbadwasser eingesetzt. Iod-Tinktur ist ein verschreibungspflichtiges Desinfektionsmittel für Wunden. 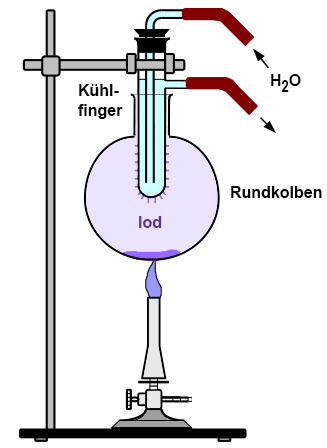
Durchführung:
Zum Sublimieren von Iod verwendet man einen
Kühlfinger, den man aus einem Reagenzglas mit Seitenrohr herstellt
und in einen Rundkolben stellt, wobei die seitlichen Öffnungen mit
Glaswolle abgedichtet werden. Im Handel sind auch dafür geeignete
Sublimationsapparaturen erhältlich.
Beobachtungen:
Das feste Iod am Boden des Rundkolbens verdampft,
ohne vorher flüssig zu werden. Die violetten Iod-Dämpfe resublimieren
am Kühlfinger, und nadelförmige Iod-Kristalle scheiden
sich daran ab.
Es existieren auch andere Stoffe, die sublimieren und resublimieren, zum Beispiel Trockeneis (festes Kohlenstoffdioxid), Benzoesäure, Campher oder Naphthalin. Die Sublimation wird im Labor als Trennmethode zur Reinigung von Stoffgemischen eingesetzt.
Hinweise und vorbereitende
Arbeiten: Zur Herstellung eines
Reagenzglases mit einem unten ausgeblasenen Loch wird das Reagenzglas mit
einem durchbohrten Stopfen verschlossen und mit einer langen Glasröhre
verbunden. Dann erhitzt man eine Stelle seitlich in Bodennähe mit
der nicht leuchtenden Flamme, bis das Glas erweicht. Durch Blasen in die
Röhre kann ein Loch erzeugt werden, das durch vorsichtiges Schlagen
auf die Unterlage erweitert wird. Zum Hineinhalten des Reagenzglases in
den Standzylinder während der Reaktion befestigt man eine Drahtschlinge
am oberen Ende. Im Laborhandel sind dafür auch spezielle Halterungen erhältlich. Es
wird empfohlen, auf dieses Experiment zu verzichten und einen Film zu zeigen.
Durchführung:
Ein erbsengroßes Stück Natrium
wird sorgfältig endrindet, mit einem Papierhandtuch getrocknet und
zu einer Kugel geformt. Das Natrium darf dabei nicht angefasst werden!
Die Kugel wird in das ausgeblasene Reagenzglas gegeben und von außen
mit der nicht leuchtenden Brennerflamme vorsichtig erhitzt, bis das Natrium
gelb aufglüht. Damit die Reaktion auch sicher anläuft, bläst
man noch vorsichtig durch das Loch kurz auf das Natrium und hält dann
das Reagenzglas in den mit Chlor gefüllten Standzylinder.
Beobachtungen: Das Natrium glüht gelb auf und verbrennt unter hellen Feuererscheinungen und Rauchentwicklung. Dabei ist manchmal auch ein Knistern zu hören. Nach der Reaktion ist das Reagenzglas mit einem weißen Belag beschlagen. Das Reagenzglas wird zerschlagen und die Reste in ein neues Reagenzglas (30×200 mm) mit Wasser gegeben. Nach der Zugabe der Silbernitrat-Lösung entsteht eine weiße Ausfällung, die Chlorid-Ionen nachweist. Theorie und ergänzende Informationen: Chlor reagiert mit Natrium in einer exothermen Reaktion zu Natriumchlorid, das in der Küche als Kochsalz bekannt ist: 2 Na + Cl2
Der Nachweis des Reaktionsproduktes beruht auf einer Fällungsreaktion des Silbernitrats mit dem Natriumchlorid (>genaue Versuchsbeschreibung): AgNO3 +
NaCl
Das dabei entstehende Silberchlorid AgCl ist nicht mehr wasserlöslich und fällt als weißer Niederschlag aus. Der Nachweis funktioniert bei allen Chloriden, Bromiden und Iodiden. Natriumchlorid ist im Gegensatz zu den Ausgangsprodukten nicht nur ein völlig harmloser Stoff, sondern stellt ein wichtiges Salz in der Nahrung des Menschen dar. In der Natur kommt es als Mineral Halit (Steinsalz) vor und wird in Salzbergwerken abgebaut. Während man früher
noch das Salz in Bergwerken eigenhändig abbaute, gewinnt man es heute
durch Einpumpen von Wasser, wobei aus dem Berg eine salzhaltige Sole zurückfließt.
Aus dieser kann das Salz durch Verdunsten des Wassers gewonnen werden.
In südlichen Ländern gewinnt man das Salz in Salinen durch Trocknung
des Meerwassers.
Bei der Reaktion von
Natrium mit Chlor gibt ein Natrium-Atom sein einzelnes Valenzelektron an die Valenzschale eines Chlor-Atoms ab. So bekommen beide Atome die Edelgaskonfiguration,
wobei die Atome eine Ladung erhalten und Ionen entstehen. Das Cl−-Ion wird als Chlorid-Ion bezeichnet und kennzeichnet
die Chloride.
Die Ladungsunterschiede
bewirken eine Anziehungskraft zwischen den Ionen, so dass eine Ionenbindung entsteht. Da die Ionen im Verhältnis 1 zu 1 vorkommen, bildet sich ein
regelmäßiges Ionengitter in würfelförmiger Anordnung.
Dies erklärt das Würfelwachstum eines Natriumchlorid-Kristalls
in der Natur. In der Natur existieren viele Minerale, die im kubischen
Kristallsystem Würfel ausbilden, doch nicht alle davon sind Halogenide.
Wird ein Kochsalz-Kristall
in Wasser gelöst, bleiben die Ionen erhalten, sie schwimmen dann aber
frei als Ladungsträger in der Lösung. Daher leitet salzhaltiges
Wasser den elektrischen Strom. Theoretisch könnte man in destilliertem
Wasser gefahrlos baden, auch wenn ein Fön hineinfällt. Aber schon
ein Löffel Salz würde dem Badespaß ein schnelles und jähes
Ende bereiten.
Ein kleines Stück Eisen-Wolle wird zu einem Zopf geformt und mit der Tiegelzange aufgenommen. Dann hält man das untere Ende kurz in die Brennerflamme, so dass es an einem kleinen Bereich zu glühen beginnt. Beim sofortigen Eintauchen der Eisen-Wolle in einen mit Chlor gefüllten Standzylinder glüht das Eisen rot auf, und eine braune Wolke steigt aus dem Standzylinder. Beim Herausziehen der Reste fällt auf, dass die Eisen-Wolle „verschwunden“ ist, während am Glas-Rand des Zylinders der rotbraune Beschlag erhalten bleibt. Es wird empfohlen, auf dieses Experiment zu verzichten und die Reaktion im Film zu zeigen. Theorie: Eisen reagiert mit Chlor in einer exothermen Reaktion zu Eisen(III)-chlorid: 2 Fe + 3 Cl2
Das Reaktionsprodukt ist ein Salz, das in der Elektronik zum Ätzen von Platinen verwendet wird. Film Zunächst füllt
man ein an einem Stativ befestigtes Reagenzglas (20×180 mm) mit Hilfe einer
Sicherheitspipette zwei Zentimeter hoch mit Brom und erwärmt das Brom kurz mit
dem Brenner. Ein 10×10 cm großes Stück Aluminium-Folie wird aufgerollt
und mit einer Tiegelzange in das flüssige Brom geworfen. Es
wird empfohlen, auf dieses Experiment zu verzichten und einen Film zu zeigen.
Beobachtungen: Nach einer Weile beginnt das Aluminium mit dem Brom zu reagieren. Glühende Partikel spritzen wie bei einem kleinen Feuerwerk heraus. Sobald alles verbleibende Brom verdampft ist, gibt man Wasser zu dem Reaktionsprodukt, dabei zersetzt sich das entstandene Aluminiumbromid stürmisch. Film Theorie:
Brom reagiert mit dem Aluminium in einer exothermen Reaktion zu Aluminiumbromid, das im Reinzustand glänzende,
farblose Blättchen bildet:
Dieser Versuch findet in einem vollständig geschlossenen System statt, wenn das vorhandene Iod vollständig reagiert. Schutzbrille und Schutzhandschuhe tragen, nur im laufenden Abzug mit Schutzscheibe durchführen. Ein großes Reagenzglas (30×200 mm) wird quer in ein Stativ gespannt. Man legt einen winzigen, etwa ein Millimeter großen Flitter Iod an das Ende des Reagenzglases in der Nähe des Bodens und gibt einen Spatel gepulvertes Magnesium in die Mitte des Reagenzglases. Dann wird das Reagenzglas mit Glaswolle verschlossen. Nun erhitzt man das Iod, so dass sich die Iod-Dämpfe im ganzen Reagenzglas ausbreiten. Danach wird das Magnesium kräftig erhitzt, bis eine Reaktion des Magnesiums mit dem Iod auftritt. Beobachtungen: Nach dem Erhitzen des Magnesiums glüht dieses hell auf, und ein weißer Rauch entsteht. Wenn man die Mengen richtig dosiert hat (es darf nur ganz wenig Iod genommen werden), verschwindet die violette Farbe des Iods fast vollständig während der Reaktion. Theorie: Magnesium reagiert mit Iod zu Magnesiumiodid, das an der weißen Farbe erkennbar ist.
Mg + I2
Aufgrund der Versuchsreihe lassen sich Verallgemeinerungen aufstellen. Immer wenn Halogene mit einem Metall reagieren, entstehen die Salze der Halogene, die Fluoride, die Chloride, die Bromide oder die Iodide. Die entstehenden Halogenide sind wasserlöslich und bilden Ionengitter. a) Ein würfelförmiger
Halit-Kristall wird gezeigt und den Schülerinnen und Schülern in die Hände gegeben.
Sie sollen den Finger befeuchten und den salzigen Geschmack des Kristalls
testen.
b) In ein Becherglas gibt man 0,1 Liter destilliertes Wasser und testet, ob das Wasser elektrisch leitfähig ist. Dann löst man langsam einen gezüchteten und großen Kochsalz-Kristall im Wasser auf, bis die Glühlampe eine Leitfähigkeit des Salzwassers anzeigt. c) In einer Schülerübung
kann gezeigt werden, dass nicht nur die Halogenide, sondern auch andere
Salze beim Auskristallisieren Kristalle mit besonderen Formen annehmen
(Download einer Arbeitsanleitung).
Schöne Fotos finden sich in der Mineraliengalerie. Je nach Kristallsystem bilden sich die Formen. Die Farben der
Mineralien werden oft durch Fremd-Atome erreicht. Das Umkristallisieren ist ein chemisches Arbeitsverfahren zur Reinigung von Stoffen.
d) Mit Silbernitrat-Lösung bilden die Halogenide einen weißen, schwer löslichen Silberhalogenid-Niederschlag (Versuchsbeschreibung). e) Der Fluorit ist ein bekanntes Mineral, das aus dem Stoff Calciumfluorid gebildet wird. Fluorite zeigen oft eine deutliche Lumineszenz, wenn Sie mit UV-Licht bestrahlt werden. Dies kann besonders schön an den Fluoriten aus England beobachtet werden: Manche Fluorite verhalten sich wie „Chamäleons“ und können
ihre Farbe wechseln: Sie erscheinen bei Kunstlicht grünlich und bei
Tageslicht
bläulich. Ein Klassiker sind
die
Fluorite aus der Blanchard Mine in England. Manche der Stücke zeigen
auch Thermolumineszenz: Sie strahlen Licht aus, wenn sie auf einer
Herdplatte
erhitzt werden.
Fluoride werden auch oft zur Fluoridierung von Lebensmitteln eingesetzt, zum Beispiel
für Trinkwasser oder im Speisesalz. Das bei der Aufnahme der Nahrung
in geringsten Konzentrationen frei werdende Fluor soll vor Karies an den Zähnen vorbeugen. Die Anwendung ist aufgrund möglicher Gesundheitsschäden
umstritten. |